A Cinética Química é um campo que estuda os fatores que influenciam a taxa de desenvolvimento das reações químicas, isto é, a velocidade com que se processam. Há cada vez mais pesquisas em torno desta área, visto que muitas vezes queremos acelerar algumas reações ou diminuir a rapidez de outras. Isso é especialmente importante para as indústrias e essas pesquisas têm importantes consequências tecnológicas.
Mas, visto que a velocidade de uma reação pode variar em cada intervalo de tempo e de uma substância para outra, costuma-se calcular a velocidade média das reações.
Considere a reação genérica a seguir, em que os coeficientes são as letras minúsculas e os reagentes e produtos estão representados pelas letras maiúsculas:
a A + b B → c C + d D
A velocidade média dessa reação será dada dividindo-se a velocidade média de reação de qualquer uma das substâncias reagentes ou a velocidade média de formação de qualquer um dos produtos pelo seu respectivo coeficiente na equação química. Isto é dado por:
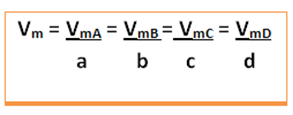
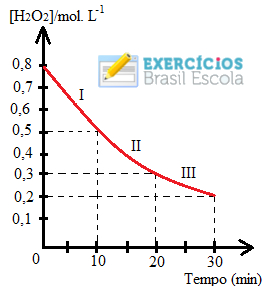
Por exemplo, considere a reação de decomposição da água oxigenada:
2 H2O2(aq) → 2 H2O(l) + 1 O2 (g)
Digamos que em 1 minuto se formaram 0,3 mol/L de H2O e 0,15 mol/L de O2, enquanto se decompôs 0,3 mol/L de H2O2, ou seja, temos que as velocidades médias de decomposição e de formação dessas substâncias da reação são de:
VmH2O2 = 0,3 mol/L . min
VmH2O = 0,3 mol/L . min
VmO2 = 0,15 mol/L . min
A velocidade média da reação global será encontrada ao pegar um desses valores e dividi-lo pelo respectivo coeficiente na equação:
Vm = VmH2O2 = 0,3 mol/L . min = 0,15 mol/L . min
2 2
Vm = VmH2O = 0,3 mol/L . min = 0,15 mol/L . min
2 2
Vm = VmO2 = 0,15 mol/L . min = 0,15 mol/L . min
1 1
Note que os três valores são iguais, portanto, a velocidade da reação é a mesma em função de qualquer reagente ou produto, num mesmo intervalo de tempo.
Porém, como se encontrou os valores das velocidades médias de cada uma das substâncias envolvidas nessas reações?
Isso pode ser calculado dividindo-se a variação da concentração da substância (reagente ou produto) pelo intervalo de tempo. Se formos determinar a velocidade média de um dos reagentes da reação, teremos que colocar um sinal negativo antes, ou então considerar o valor da concentração em módulo ||, pois, visto que a concentração do reagente diminui com o passar do tempo, o valor da velocidade seria negativo, mas não existe velocidade negativa.

Por exemplo, considere a seguinte reação de decomposição do gás ozônio (O3(g)) em gás oxigênio (O2(g)):
2 O3(g) → 3 O2(g)
Digamos que num balão havia 10 mol de gás ozônio, mas após 1 minuto, restaram apenas 4 mol; isto significa que 6 mol de ozônio transformaram-se em gás oxigênio. Assim, temos:
2 O3(g) → 3 O2(g)
t = 0 min 2 mol/L 0 mol/L
gastos formados
6 mol/L 9 mol/L
t = 1 min 4 mol/L 9 mol/L
Veja que como a proporção da reação é de 2:3, então, se foram gastos 6 mol de O3, foram formados 9 mol de O2. Assim, após 1 minuto, temos as seguintes velocidades médias:
Vm = - ∆ [O3]
∆t
Vm = - ([O3final - O3inicial])
tfinal - tinicial
Vm = - ([4 - 10])
1– 0
Vm = 6 mol/L . min→ Durante 1 minuto, 6 mol de ozônio reagiram em cada litro do sistema.
Vm = ∆ [O2]
∆t
Vm = ([O2final - O2inicial])
tfinal - tinicial
Vm = ([9 - 0])
1– 0
Vm = 9 mol/L . min→ Durante 1 minuto, 9 mol de oxigênio foram formados em cada litro do sistema.
Isso nos mostra que podemos calcular a velocidade média em função dos reagentes ou em função dos produtos.
Agora, se quisermos calcular a velocidade média dessa reação global, basta fazer como mostramos no início: dividir cada uma dessas velocidades pelos seus respectivos coeficientes na equação química:
Vm = VmO3 = 6 mol/L . min = 3 mol/L . min
2 21
Vm = VmO2 = 9 mol/L . min = 3 mol/L . min
3 3
Vm = VmO3 = VmO2
2 3
Por Jennifer Fogaça
Graduada em Química