Enzimas são catalisadores biológicos responsáveis por aumentar a velocidade de uma determinada reação química. Geralmente as enzimas são proteínas, mas existem alguns ácidos ribonucleicos que atuam como enzimas, sendo chamados de ribozimas.
Para que possam aumentar a velocidade de uma reação, as enzimas devem se ligar a reagentes, os quais são conhecidos como substratos. Por muito tempo, acreditou-se que essa ligação ocorria de maneira bastante rígida, um modelo conhecido como chave-fechadura. Atualmente, no entanto, aceita-se o modelo conhecido como encaixe induzido, o qual admite que leves mudanças ocorrem na forma da enzima à medida que o substrato entra no sítio ativo.
Leia também: O que é metabolismo?
Tópicos deste artigo
- 1 - O que são enzimas?
- 2 - Toda enzima é uma proteína?
- 3 - Complexo enzima-substrato
- 4 - Cofatores
- 5 - Classificação das enzimas
- 6 - Fatores que regulam a atividade enzimática
O que são enzimas?
As enzimas são biomoléculas que atuam como catalisadores, ou seja, são substâncias capazes de acelerar a velocidade das reações químicas que ocorrem nos seres vivos sem que sejam consumidas durante essas reações. Sem a ação das enzimas, algumas reações seriam muito lentas, o que prejudicaria o metabolismo. As enzimas aceleram as reações de forma seletiva, sendo, portanto, catalisadores muito específicos.
As enzimas são capazes de acelerar uma reação mediante a diminuição da energia de ativação, ou seja, elas reduzem a quantidade de energia que deve ser adicionada para que uma reação tenha início.
[publicação_omnia]
Toda enzima é uma proteína?
Apesar de serem frequentemente definidas como catalisadores biológicos de natureza proteica, nem toda enzima é uma proteína. Há alguns RNAs que funcionam como enzimas, os chamados ribozimas. A maioria das enzimas, no entanto, são proteínas, sendo formadas, portanto, por aminoácidos. A composição de aminoácidos dessas biomoléculas define a estrutura tridimensional que ela irá adquirir.
Leia também: Como atuam as substâncias catalisadoras?
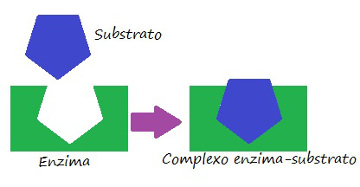
Complexo enzima-substrato
Denomina-se de substrato o reagente sobre o qual uma enzima age. Quando uma enzima se liga ao seu substrato, forma-se o complexo enzima-substrato. Essa ligação acontece em uma região específica, chamada de sítio ativo.
Quando falamos das enzimas de natureza proteica, o sítio ativo corresponde a apenas alguns poucos aminoácidos, sendo o restante da molécula responsável por determinar a configuração do sítio ativo. A forma do sítio ativo, bem como a forma do substrato estão relacionadas à especificidade da enzima, uma vez que eles devem ser complementares.
-
Modelo chave-fechadura
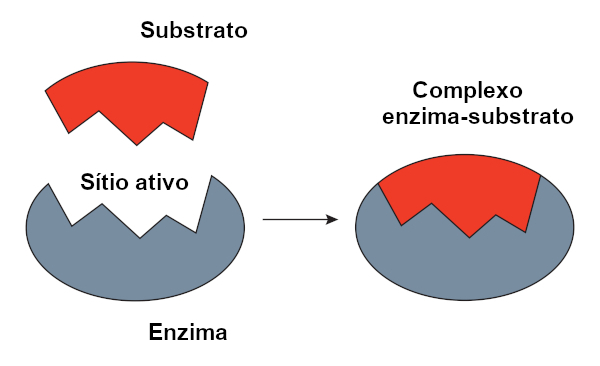
O modelo chave-fechadura, proposto por Emil Fischer, é bastante difundido para explicar a interação entre enzima e substrato. De acordo com esse modelo, há uma complementaridade rígida entre a enzima e o substrato, assim como uma chave e uma fechadura. O sítio ativo da enzima teria um formato complementar ao substrato, o qual se encaixaria perfeitamente. Outras moléculas, portanto, não teriam acesso a esse sítio, o que garantiria a especificidade da enzima. Assim como uma chave abre apenas uma fechadura, uma enzima só se ligaria a um substrato. Hoje sabemos, no entanto, que esse modelo não está correto, uma vez que as enzimas não são estruturas rígidas como se pensava.
-
Modelo do encaixe induzido
Atualmente, o modelo mais aceito para explicar a ligação entre uma enzima e o seu substrato é o do encaixe induzido, proposto inicialmente por Koshland e colaboradores. O sítio ativo e o substrato não funcionam de maneira rígida como uma chave e fechadura. Pesquisas mostram que, à medida que o substrato entra no sítio ativo, a enzima sofre uma leve modificação, a qual favorece o ajuste entre o sítio ativo e o substrato. Para compreender melhor esse modelo, podemos pensar na interação da enzima e substrato como um aperto de mão, o qual vai se tornando mais firme após o primeiro contato.
Cofatores
Grande parte das enzimas precisa de moléculas auxiliares para realizar a sua ação catalítica, chamadas de cofatores. Os cofatores podem estar ligados permanentemente à enzima ou podem se ligar ao substrato de maneira fraca e reversível. Eles também podem ser inorgânicos ou orgânicos. Quando os cofatores são moléculas orgânicas, são denominados coenzimas.
Algumas vitaminas atuam como coenzimas, sendo esse o caso, por exemplo, da riboflavina, também conhecida como vitamina B2. Como exemplos de cofatores inorgânicos, podemos citar o ferro e zinco na sua forma iônica.
Leia também: Vitaminas do complexo B — grupo de vitaminas que geralmente atuam como coenzimas
Classificação das enzimas
As enzimas podem ser classificadas em seis grupos, utilizando-se como critério o tipo de reação que catalisam.
-
Oxidoredutases: enzimas relacionadas com as reações de oxirredução.
-
Transferases: catalisam a transferência de grupos de um composto para outro.
-
Hidrolases: catalisam reações de hidrólise.
-
Liases: atuam na adição de grupos a ligações duplas ou remoção de grupos formando uma ligação dupla.
-
Isomerases: catalisam reações de isomerização.
-
Ligases: enzimas que provocam a degradação da molécula de ATP, usando a energia liberada nessa reação para a formação de novos compostos.
Fatores que regulam a atividade enzimática
A atividade de uma enzima é influenciada por fatores, sendo os principais a temperatura e o pH. Geralmente a temperatura exerce um papel positivo nas reações químicas, aumentando a taxa de uma reação enzimática. Porém, quando a temperatura aumenta acima das condições ótimas, a velocidade da reação cai consideravelmente. Isso ocorre porque se observa a desnaturação das proteínas. A maioria das enzimas dos seres humanos apresenta uma temperatura ótima entre 35 e 40 ºC. Além da temperatura, o pH também influencia a atividade enzimática, existindo também um valor ótimo. Para a maioria das enzimas, o valor ótimo de pH está na faixa de 6 a 8.