Para que uma reação química ocorra é necessário satisfazer quatro condições básicas, que são:
1. Os reagentes devem entrar em contato;
2. Deve haver afinidade química entre os reagentes;
3. As colisões entre as partículas dos reagentes devem ser eficazes;
4. Deve-se atingir a energia de ativação.
Veja resumidamente cada caso:
1.Contato entre os reagentes:
Essa condição é óbvia, pois mesmo que os reagentes tenham bastante afinidade um com o outro, como acontece no caso dos ácidos e das bases, se eles estiverem separados, a reação não ocorrerá. Eles precisam entrar em contato para que suas partículas possam colidir, rompendo as ligações dos reagentes e formando as ligações dos produtos.

2.Afinidade química:
Como vimos, colocar os reagentes em contato é necessário, mas não é o suficiente. Por exemplo, se colocarmos o sódio em contato com a água, ocorrerá uma reação extremamente violenta, já se colocarmos o ouro, não veremos diferença nenhuma. Isso acontece porque substâncias diferentes possuem diferentes afinidades químicas entre si, ou então, podem também não possuir afinidade nenhuma. Quanto maior for a afinidade química, mais rápida será a reação.
Nos exemplos citados, o sódio possui grande afinidade com a água, tanto que para não entrar em contato com a umidade do ar, o sódio metálico é guardado em querosene. Já o ouro é inerte, por isso que monumentos de ouro duram tanto tempo, como os sarcófagos do Egito.

3.Teoria das colisões:
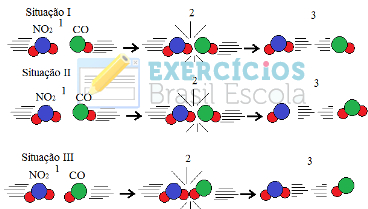
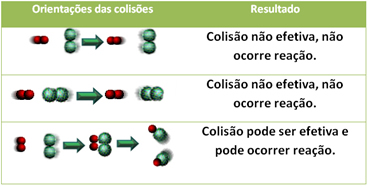
Mesmo em compostos que possuem afinidade química, para que a reação se processe é necessário que suas partículas, átomos ou moléculas, colidam de forma eficaz. Nem todas as partículas que se chocam fazem isso de forma eficaz, mas os choques que resultam em quebra das ligações dos reagentes e formação de novas ligações são aqueles que ocorrem na orientação correta e com a energia suficiente.
Abaixo, é mostrado o caso de duas colisões não eficazes e uma eficaz que resulta na ocorrência da reação.
4.Energia de ativação e complexo ativado:
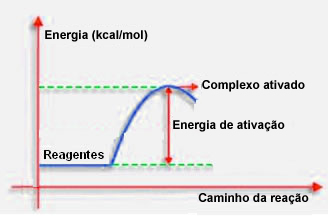
Conforme dito no item anterior, a colisão eficaz, além da orientação favorável, precisa também de energia suficiente. A quantidade mínima de energia necessária para que cada reação ocorra é chamada de energia de ativação.
Se os reagentes tiverem uma energia igual ou superior à energia de ativação, durante o choque bem orientado, se formará um complexo ativado inicialmente, que é uma estrutura intermediária entre os reagentes e os produtos. No complexo ativado, existem as ligações dos reagentes enfraquecidas e as novas ligações de produto se formando.
Assim, a energia de ativação funciona como uma espécie de barreira para que a reação ocorra, pois quanto maior ela for, mais difícil será para a reação ocorrer. Em alguns casos, é preciso fornecer energia para os reagentes. Por exemplo, o gás de cozinha tem afinidade para interagir com o oxigênio do ar, mas precisamos fornecer energia quando aproximamos o palito de fósforo, senão a reação não ocorre. Mas, depois de uma vez iniciada, a própria reação libera energia suficiente para ativar as outras moléculas e manter a reação ocorrendo.
Por Jennifer Fogaça
Graduada em Química