Os catalisadores são substâncias capazes de acelerar uma reação sem sofrerem alteração, isto é, não são consumidas durante a reação.
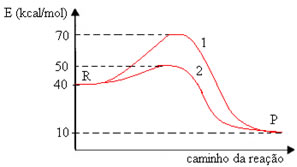
Para entendermos como atuam os catalisadores, precisamos nos lembrar do que foi explicado no texto “Energia de ativação”. Conforme mostrado lá, para que uma reação química se inicie, é necessário que os reagentes tenham ou recebam certa quantidade de energia mínima, que é denominada de energia de ativação.
Com essa energia mínima, os reagentes conseguem atingir o complexo ativado, que é um estado intermediário (estado de transição) que se forma entre os reagentes e os produtos, em cuja estrutura existem as ligações anteriores enfraquecidas e a formação de novas ligações (presentes nos produtos).
Por exemplo, considere a reação genérica abaixo:

Observe que a energia de ativação necessária para atingir o complexo ativado se torna uma espécie de obstáculo que precisa ser ultrapassado para que a reação ocorra. Isso significa que quanto maior for a energia de ativação de uma reação, maior será o obstáculo a ser vencido e menor será a velocidade da reação.
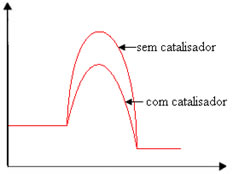
O contrário também é verdadeiro, se a energia de ativação for menor, a reação será mais rápida. É exatamente isso que os catalisadores fazem, eles criam um caminho alternativo, que exige menor energia de ativação, fazendo com que a reação se processe de forma mais rápida.
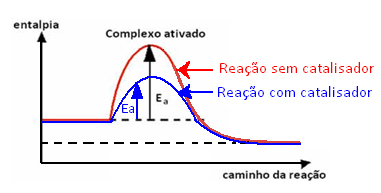
Para conseguir abaixar a energia de ativação, o catalisador age mudando o mecanismo da reação, por se combinar com os reagentes num sistema que pode ser monofásico (catálise homogênea) ou polifásico (catálise heterogênea).
Mais detalhes sobre esses tipos de catálises podem ser vistos nos textos abaixo:
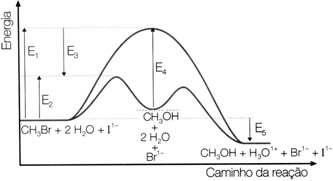
Mas, de forma genérica, podemos dizer que essa combinação entre o reagente e o catalisador forma um composto intermediário que depois se transforma, originando o produto e o catalisador. Observe como isso pode ser representado:
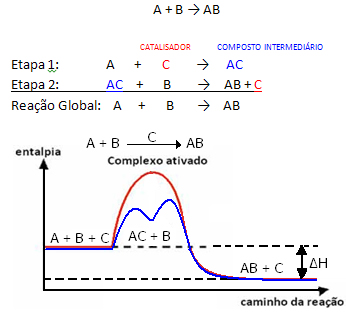
Veja que o catalisador é regenerado ao final da reação, não sendo consumido por ela.
Um fato importante é que o catalisador acelera tanto a reação direta quanto a inversa, isso significa que ele diminui a energia de ativação de ambas.
Por Jennifer Fogaça
Graduada em Química