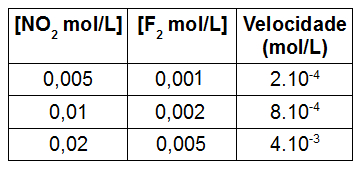
Conforme explicado no texto Lei da velocidade das reações químicas, a equação usada para representar a lei da velocidade de uma reação é dada pelo produto entre a constante característica da reação numa determinada temperatura e as concentrações dos reagentes elevadas aos seus respectivos expoentes: v = k . [A]α. [B]β.
Veja um exemplo:
2NO(g) → N2O2(g)
A equação da velocidade dessa reação é dada por: v = k . [NO]2.
Isso significa que em todos os casos o expoente da concentração do reagente será exatamente igual ao seu coeficiente na reação?
Não. Isso só aconteceu nesse caso porque se trata de uma reação elementar, ou seja, é uma reação que ocorre numa única etapa, sem compostos intermediários. Nos casos em que a reação não for elementar, os expoentes devem ser determinados experimentalmente. Mas, como isso é feito? E como é possível saber se a reação é elementar ou não?
Bem, vamos considerar outra reação:
CO + NO2 → CO2 + NO
Digamos que um cientista realizou essa reação diversas vezes, alterando a concentração dos reagentes de formas diferentes, mas mantendo a temperatura constante. Ele obteve os seguintes dados:
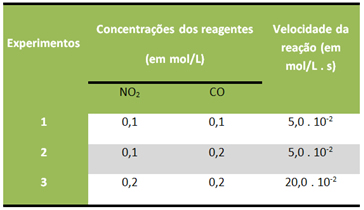
Observe que, da primeira para a segunda etapa, ele dobou a concentração do CO, o que não alterou a velocidade da reação.

Portanto, o expoente dessa substância é zero. Como qualquer número elevado a zero é igual a 1, o CO não participa da equação da velocidade da reação.
Agora, veja que do 2º experimento para o 3º dobrou-se a concentração do NO2, o que fez com que a velocidade da reação quadruplicasse.

Assim, o expoente da concentração dessa substância na equação da velocidade das reações é igual a 2 (4/2).
Desse modo, descobrimos qual é a equação da velocidade dessa reação: v = k . [NO2]2.
Veja que nesse caso o expoente na equação não foi igual ao coeficiente na reação. Portanto, podemos concluir que essa reação não é elementar. Depois de verificar experimentalmente a lei da velocidade, o cientista deveria então sugerir um mecanismo que explicasse essa reação, ou seja, ele deveria propor um conjunto de etapas coerentes com os dados experimentais desse processo.
Foi proposto o seguinte mecanismo:
Etapa 1 (lenta): NO2(g) + NO2(g) → NO3(g) + NO(g)
Etapa 2 (rápida):NO3(g) + CO(g) → CO2(g) + NO2(g)
Equação global:CO + NO2 → CO2 + NO
Veja que a lei da velocidade experimental coincide com a etapa mais lenta:
vglobal = vetapa lenta
k . [NO2]2 = k . [NO2] . [NO2]
Isso nos mostra que, em qualquer mecanismo, a etapa determinante da taxa de desenvolvimento de uma reação será sempre a etapa lenta, ou seja, a taxa de desenvolvimento da reação global será proporcional apenas às concentrações dos reagentes que participaram da etapa lenta.
É importante determinar corretamente esses expoentes porque são eles que irão indicar qual é a ordem da reação.
Por Jennifer Fogaça
Graduada em Química