A oxirredução, ou simplesmente redox, é um processo químico em que ocorre a transferência de elétrons entre alguns elementos de reagentes da reação. O elemento que perde elétrons sofre uma reação de oxidação, enquanto o elemento que recebe elétrons sofre uma reação de redução. A oxidação e a redução são reações que devem ocorrer de forma simultânea, sendo assim, não há como ocorrerem de forma isolada.
A oxirredução está presente em diversos processos de interesse para a indústria e sociedade. As pilhas e baterias, tão utilizadas por nós em dispositivos eletrônicos, geram energia elétrica por meio do processo de oxirredução. Muitos metais são obtidos na forma pura por meio de reações de oxirredução. A oxirredução também tem grande importância na bioquímica, sendo utilizada para explicar, inclusive, o envelhecimento do ser humano.
Leia também: Reações de oxirredução com íons – baseadas na teoria de conservação do somatório de cargas
Tópicos deste artigo
- 1 - Resumo sobre oxirredução
- 2 - O que é oxirredução?
- 3 - Como ocorre a oxirredução?
- 4 - Balanceamento por oxirredução
- 5 - Tipos de oxirredução
- 6 - Exercícios resolvidos sobre oxirredução
Resumo sobre oxirredução
-
Oxirredução, ou redox, é o processo químico de transferência de elétrons entre alguns elementos de reagentes da reação.
-
O elemento que perde elétrons sofre oxidação, enquanto o elemento que ganha elétrons sofre redução.
-
O agente oxidante é a substância química que causa oxidação. O agente redutor é a substância química que causa a redução.
-
Não ocorre oxidação sem que ocorra redução, tais processos são simultâneos.
-
Uma reação química pode ser balanceada pelo método da oxirredução, baseando-se no princípio da conservação de carga.
-
As reações redox estão presentes na fotossíntese, na combustão, na corrosão, além de outros processos de interesse para a sociedade.
O que é oxirredução?
Oxirredução, ou redox, é o processo químico de transferência de elétrons entre alguns elementos de reagentes da reação. O nome “oxirredução” é uma contração das palavras “oxidação” e “redução”, as duas reações que ocorrem de forma simultânea na transferência dos elétrons. O elemento que perde elétrons sofre a reação de oxidação, enquanto o elemento que recebe elétrons sofre a reação de redução.

Como ocorre a oxirredução?
A oxirredução ocorre por meio da transferência de elétrons entre alguns elementos dos reagentes participantes da reação química. Entretanto, nem sempre essa transferência de elétrons ocorre de forma espontânea.
Nas pilhas alcalinas, por exemplo, o processo de oxirredução é espontâneo, inclusive transformando a energia química em energia elétrica. Já, por exemplo, na obtenção de alguns metais, como sódio e alumínio, a oxirredução não ocorre de forma espontânea, sendo necessário a utilização de energia térmica e elétrica para a ocorrência do processo.
Devemos entender que, na oxirredução, as reações de oxidação e redução ocorrem simultaneamente. Na oxidação ocorre a perda do elétron por parte do reagente. Como consequência, o seu Número de Oxidação (NOx) é aumentado, uma vez que há perda de espécies de carga elétrica negativa, ou seja, o reagente se torna mais positivo após o processo. Observe uma reação de oxidação a seguir.
Ax → An+x + n elétrons
Nesse caso, x é a carga (NOx) inicial do reagente hipotético A, enquanto n é o número de elétrons perdidos no processo. Observe que a carga final de A aumenta a de n, sendo então calculada como n + x.
Já na redução ocorre a recepção do elétron por parte do reagente, o oposto da oxidação. Como consequência, o NOx do reagente cai, uma vez que há ganho de espécies de carga elétrica negativa, ou seja, o reagente se torna mais negativo após o processo. Observe a seguir.
By + n elétrons → By-n
Nesse caso, y é a carga inicial do reagente hipotético B, enquanto n é o número de elétrons adquirido no processo. A carga final de B diminui em n, sendo então calculada como y – n.
Exemplo:
Para entender melhor o processo redox, vamos atentar para a obtenção do ferro metálico da hematita, minério em que o ferro está na forma de Fe2O3 majoritariamente. Podemos resumir a obtenção do ferro em três etapas básicas, as quais são, inclusive, de oxirredução.
1ª etapa: oxirredução para a obtenção do monóxido de carbono por meio da combustão incompleta coque (C).
2 C (s) + O2 (g) → 2 CO (g)
Nessa etapa, perceba que o NOx do carbono varia de zero para +2, enquanto o NOx do oxigênio varia de zero para -2. Isso significa que, nesse processo, cada carbono cedeu dois elétrons para cada oxigênio. Sendo assim, o elemento carbono se oxidou, enquanto o elemento oxigênio se reduziu.
Aqui também podemos aproveitar para falar sobre os agentes oxidante e redutor. Até agora falamos que um reagente sofre oxidação ou sofre redução, um procedimento passivo. Contudo, podemos entender que isso só ocorre porque há uma substância agindo para tanto.
A substância responsável por oxidar um reagente é chamada de agente oxidante. No processo anterior, então, podemos dizer que o elemento carbono foi oxidado pela substância gás oxigênio (O2), a qual será considerada como agente oxidante. Já a substância responsável por reduzir um reagente é chamada de agente redutor. No processo anterior, temos o elemento oxigênio sendo reduzido por ação da substância coque (C), a qual será considerada como agente redutor.
É importante salientar que quem sofre oxidação ou redução são os elementos químicos, enquanto os agentes oxidante e redutor são substâncias químicas e não elementos isolados.

2ª etapa: redução parcial do ferro (Fe2O3 a FeO) pelo CO, resultando na oxidação do carbono (CO a CO2).
Fe2O3 (s) + CO (g) → 2 FeO (s) + CO2 (g)
Nesse caso, o ferro tem seu NOx reduzido, passando de +3 para +2, indicando que, para isso, recebeu elétrons, sofrendo então redução. Já o carbono passou do NOx +2 para +4, indicando que, para isso, perdeu elétrons, sofrendo então oxidação.
O agente oxidante é o Fe2O3, pois o carbono sofre oxidação, enquanto o CO é o agente redutor, pois o ferro sofre redução.
3ª etapa: redução final do ferro (FeO a Fe) pelo CO, resultando na oxidação do carbono (CO a CO2).
FeO (s) + CO (g) → Fe + CO2 (g)
Nessa última etapa, o ferro tem novamente seu NOx reduzido, mas dessa vez de +2 para zero, indicando que, para isso, recebeu elétrons, sofrendo então redução. Já o carbono, novamente, passa do NOx +2 para +4, em um processo de oxidação, já que perdeu elétrons.
Desta vez, o agente oxidante é o FeO, pois o carbono sofre oxidação, enquanto o CO é novamente o agente redutor, pois o ferro sofre redução.
Veja também: Reações de oxirredução envolvendo água oxigenada
Balanceamento por oxirredução
O célebre francês Antoine Lavoisier, considerado o pai da química moderna, deixou-nos a lei da conservação de massa, conhecida também como lei de Lavoisier, em sua homenagem. Essa famosa lei diz que, em um sistema fechado, uma reação química ocorre com conservação de massa. Muitos são os que citam sua frase “Na natureza, nada se cria, nada se perde, tudo se transforma” para enunciar essa lei.
No entanto, além de conservação de massa, uma reação química também precisa ter conservação de cargas, ou seja, o somatório de cargas (NOx) dos reagentes deve ser igual ao somatório de cargas dos produtos. É por meio desse princípio que se desenvolveu a técnica de balanceamento de reações químicas por oxirredução. Vejamos o exemplo a seguir para entender esse método.
Br2 + HClO + H2O → HBrO3 + Hcl
1. Determinar o NOx de todos os elementos envolvidos na reação.
- No Br2: Br tem NOx zero.
-
No HClO: H tem NOx +1, Cl tem NOx +1 e O tem NOx -2.
-
No H2O: H tem NOx +1 e O tem NOx -2.
-
No HBrO3: H tem NOx +1, Br tem NOx +5 e O tem NOx -2.
-
No HCl: H tem NOx +1 e Cl tem NOx -1.
2. Registrar os elementos que apresentam variação no NOx.
- O Br passou de 0 para +5, enquanto o Cl passou de +1 para -1.
3. Determinar o número de elétrons transferidos
- Br0 para Br5+, ou seja, houve perda de 5 elétrons.
-
Cl+1 para Cl–1, ou seja, houve ganho de 2 elétrons.
4. Aplicar a conservação de carga, igualando o número de elétrons perdidos com o número de elétrons ganhos por meio de um MMC.
- 5 elétrons perdidos x 2 = 10 elétrons perdidos
-
2 elétrons ganhos x 5 = 10 elétrons ganhos
5. Multiplicar as espécies envolvidas pelo número utilizado para igualar a quantidade de elétrons. Nesse caso, foi utilizado o número 2 para igualar o número de elétrons perdidos. Assim, todas as substâncias de bromo que participam do processo redox serão multiplicadas por 2. Contudo, como o bromo está com atomicidade 2 no Br2, não se deve multiplicar essa espécie por 2, uma vez que já estão lá 2 átomos de bromo. Já o número 5 foi utilizado para igualar o número de elétrons ganhos, ou seja, todas as substâncias de cloro que participaram do processo redox serão multiplicadas por 5.
Br2 + 5 HClO + H2O → 2 HBrO3 + 5 Hcl
6. Completar o balanceamento das espécies não envolvidas no processo redox pelo método de tentativa e erro, como é realizado comumente. Entretanto, o número de hidrogênios e oxigênios já estava correto, não necessitando de intervenção. A reação balanceada é então:
Br2 + 5 HClO + H2O → 2 HBrO3 + 5 Hcl
Leia também: Reações com mais de uma oxidação e/ou redução
-
Videoaula sobre balanceamento de equações por oxirredução
Tipos de oxirredução
Analisando quimicamente, toda oxirredução é igual. Entretanto, alguns processos de oxirredução são bastante comuns no cotidiano, portanto, é interessante entendermos um pouco sobre eles.
-
Corrosão
Um dos principais problemas em estruturas metálicas, a corrosão é o processo de oxidação do metal por ação do oxigênio do ar ou da água. Popularmente, a corrosão é conhecida como enferrujamento.
Tal processo é muito danoso, pois, ao se oxidar, o metal transforma-se em óxido. O óxido não possui as mesmas características físicas e químicas do metal, como resistência mecânica, térmica, condutividade elétrica no estado sólido, tenacidade, entre outros, pelo contrário, torna-se quebradiço, com baixa resistência mecânica, podendo causar rupturas, rachaduras ou até mesmo a destruição da peça. Além disso, o óxido não carrega o brilho metálico característico, deixando a estrutura visualmente pior.

Contudo, já existem técnicas anticorrosão, como é o caso dos metais de sacrifício (pequenas estruturas metálicas colocadas na estrutura principal para oxidarem no lugar desta), processos de galvanização e até mesmo tintas anticorrosivas.
-
Combustão
A combustão é popularmente conhecida como queima. Nessa reação, um combustível sofre oxidação por ação de um comburente, geralmente o gás oxigênio, que atua, então, como agente oxidante.
A combustão é ainda muito útil para a sociedade, devido à grande quantidade de energia que pode ser gerada nesse processo químico. Os carros, por exemplo, obtêm energia para se movimentar por meio da combustão de gasolina, etanol, gás natural ou diesel dentro da câmara de ar do motor.
Contudo, devido ao aquecimento global antropogênico, as usinas termoelétricas (que geram energia por combustão) e os carros à combustão têm sofrido ações restritivas por alguns países, uma vez que o processo de combustão completa gera dióxido de carbono, um gás do efeito estufa. A combustão completa do gás natural metano demonstra a produção de CO2. Na reação a seguir, perceba que o carbono passa de NOx -4 para +4, enquanto o oxigênio passa de NOx zero para -2.
CH4 (l) + 2 O2 (g) → CO2 (g) + 2 H2O (g)
-
Fotossíntese
Um dos processos bioquímicos mais importantes, a fotossíntese também ocorre por meio de uma reação de oxirredução. Embora muito complexa, sabe-se que a fotossíntese é um processo químico, impulsionado pela luz, em que organismos produzem seu próprio alimento (carboidratos) por meio da fixação do CO2 presente na atmosfera. As plantas realizam tal procedimento para a obtenção de energia e, por isso, são grandes aliadas no combate ao aquecimento global antropogênico.
A fotossíntese também é importante, pois também produz o oxigênio, utilizado por muitos seres vivos para a obtenção de energia por meio da respiração celular. A reação da fotossíntese pode ser descrita como:
3 CO2 + 6 H2O → C3H6O3 + 3 O2 + 3 H2O
O carbono do dióxido de carbono inicia a fotossíntese com NOx igual a +4, passando para NOx que varia de -1 a +1 no sacarídeo C3H6O3. Já o oxigênio começa com NOx igual a -2 e passa a ter NOx igual a zero no gás oxigênio.

-
Outros processos
Outros processos cotidianos ocorrem por meio da oxirredução. Como já citamos, a produção dos metais envolve processos de oxirredução, assim como:
- a decomposição da matéria orgânica do lixo, produzindo metano;
-
a nossa respiração;
-
a energia elétrica gerada por pilhas e baterias.
Assim, são diversos os processos que envolvem as reações redox, mostrando como esse mecanismo é de suma importância para a química.
Leia também: Qual a relação entre a maresia e a corrosão os metais?
Exercícios resolvidos sobre oxirredução
Questão 1 - (Enem 2019) Estudos mostram o desenvolvimento de biochips utilizados para auxiliar o diagnóstico de diabetes melito, doença evidenciada pelo excesso de glicose no organismo. O teste é simples e consiste em duas reações sequenciais na superfície do biochip, entre a amostra de soro sanguíneo do paciente, enzimas específicas e reagente (iodeto de potássio, KI), conforme mostrado na imagem.
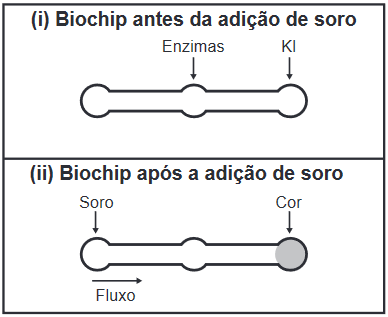
Após a adição de soro sanguíneo, o fluxo desloca-se espontaneamente da esquerda para a direita (ii), promovendo reações sequenciais, conforme as equações 1 e 2. Na primeira, há conversão de glicose do sangue em ácido glucônico, gerando peróxido de hidrogênio:
C6H12O6 (aq) + O2 (g) + H2O (l) → C6H12O7 (aq) + H2O2 (aq)
Na segunda, o peróxido de hidrogênio reage com os íons iodeto, gerando o íon tri-iodeto, água e oxigênio.
2 H2O2 (aq) + 3 I– (aq) → I3– (aq) + 2 H2O (l) + O2 (g)
GARCIA, P. T. et al. A Handheld Stamping Process to Fabricate Microfluidic Paper-Based Analytical Devices with Chemically Modified Surface for Clinical Assays. RSC Advances, v. 4, 13 ago. 2014 (adaptado).
O tipo de reação que ocorre na superfície do biochip, nas duas reações do processo, é
A) análise.
B) síntese.
C) oxirredução.
D) complexação.
E) ácido-base.
Resolução
Alternativa C
Em ambas reações, é possível perceber que as espécies mudam de NOx. Na reação 1, vê-se que o oxigênio muda seu NOx de zero (O2) para -2 (C6H12O7) e também de -2 (H2O) para -1 (H2O2). Já na reação 2, vê-se que o oxigênio se decompõe, saindo do NOx -1 (H2O2) e formando duas espécies com NOx diferente: -2 (H2O) e zero (O2). O iodo também muda de NOx, passando de -1 para -1/3.
Essas variações de carga indicam, portanto, que estamos diante de uma reação de oxirredução, alternativa C.
Questão 2 - (UERJ 2020) Para a análise do teor de ozônio em um meio aquoso, utiliza-se iodeto de potássio e ácido sulfúrico. Esses compostos reagem conforme a seguinte equação:
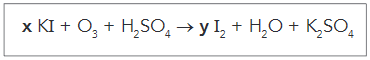
Quando a equação é balanceada, os coeficientes x e y correspondem, respectivamente, aos seguintes valores:
A) 2 e 1
B) 4 e 2
C) 6 e 3
D) 8 e 4
Resolução
Alternativa C
Nessa questão, o balanceamento pelo método das tentativas não é tão simples, exigindo muitas alterações. Quando isso ocorre, mais vale utilizar o balanceamento redox. Vamos, então, seguir as etapas necessárias.
1. Determinar o NOx de todos os elementos envolvidos na reação.
- No KI: K tem NOx +1 e I tem NOx -1.
-
No O3: O tem NOx 0.
-
No H2SO4: H tem NOx +1, S tem NOx +6 e O tem NOx -2.
-
No I2: I tem NOx zero.
-
No H2O: H tem NOx +1 e O tem NOx -2.
-
No K2SO4: K tem NOx +1, S tem NOx +6 e O tem NOx -2.
2. Registrar os elementos que apresentam variação no NOx.
- O I passou de -1 para 0, enquanto o O passou de 0 para -2.
Contudo, qual oxigênio devemos utilizar? Nesse caso temos que considerar o do ozônio (O3) e da água (H2O). O oxigênio do sulfato (SO4) não participa do processo redox, uma vez que esse ânion não sofre nenhuma alteração ao longo do processo reacional.
3. Determinar o número de elétrons transferidos.
- I–1 para I0, ou seja, houve perda de 1 elétron.
- O0 para O–2, ou seja, houve ganho de 2 elétrons.
4. Aplicar a conservação de carga, igualando o número de elétrons perdidos com o número de elétrons ganhos por meio de um MMC.
- 1 elétron perdido x 2 = 2 elétrons perdidos
- 2 elétrons ganhos x 1 = 2 elétrons ganhos
5. Multiplicar as espécies envolvidas pelo número utilizado para igualar a quantidade de elétrons. Nesse caso, foi utilizado o número 2 para igualar o número de elétrons perdidos. Assim, todas as substâncias de iodo que participam do processo redox serão multiplicadas por 2. Contudo, como o iodo está com atomicidade 2 no I2, não se deve multiplicar essa espécie por 2, uma vez que já estão lá 2 átomos de iodo. Já o número 1 foi utilizado para igualar o número de elétrons ganhos, ou seja, todas as substâncias de oxigênio que participaram do processo redox serão multiplicadas por 1.
2 KI + O3 + H2SO4 → I2 + H2O + K2SO4
6. Completar o balanceamento das espécies não envolvidas no processo redox pelo método de tentativa e erro, como é realizado comumente. A reação balanceada é então:
6 KI + O3 + 3 H2SO4 → 3 I2 + 3 H2O + 3 K2SO4
Assim, podemos concluir que os valores de x e y são 6 e 3, marcando a opção C.
Por Stéfano Araújo Novais
Professor de Química


