As pilhas são sistemas eletroquímicos que transformam energia química em energia elétrica por meio de reações de oxirredução espontâneas. Dentro da Química, as pilhas são conhecidas como células galvânicas, ou voltaicas, que são os sistemas capazes de produzir corrente elétrica por meio de uma reação de oxirredução.
As pilhas têm esse nome em referência ao primeiro dispositivo criado pelo italiano Alessandro Volta, pois sua célula galvânica era formada por discos metálicos empilhados de forma alternada. Muitas são as utilidades da pilha em nossa sociedade, não só pela sua utilização em eletroportáteis, mas também por serem utilizadas na confecção de baterias, dispositivos que entregam uma maior voltagem e são capazes de prover corrente elétrica para dispositivos maiores, como os carros.
Leia também: Como calcular o potencial de uma pilha?
Tópicos deste artigo
- 1 - Resumo sobre pilhas
- 2 - Videoaula sobre pilhas
- 3 - O que são pilhas?
- 4 - Como funcionam as pilhas?
- 5 - Componentes de uma pilha
- 6 - Tipos de pilhas
- 7 - Exercícios resolvidos sobre pilhas
Resumo sobre pilhas
-
Pilhas são sistemas eletroquímicos que produzem energia elétrica por meio de reações de oxirredução espontâneas.
-
São classificadas como células galvânicas ou células voltaicas.
-
A energia química se transforma em energia elétrica por meio do fluxo ordenado de elétrons gerados nas reações.
-
As pilhas podem ser recarregadas ou não, dependendo das reações químicas envolvidas.
-
Entre as principais pilhas, estão as secas, alcalinas, de mercúrio, além das baterias.
-
As pilhas e baterias são amplamente utilizadas em dispositivos eletrônicos e até mesmo em automóveis.
Videoaula sobre pilhas
O que são pilhas?
Pilhas são sistemas eletroquímicos capazes de produzir corrente elétrica por meio de reações de oxirredução espontâneas, ou seja, são capazes de transformar energia química em energia elétrica.
As reações de oxirredução criam uma diferença de potencial dentro da pilha, permitindo o fluxo de elétrons dentro do sistema, ocasionando uma corrente elétrica.
As pilhas são classificadas como células galvânicas ou células voltaicas. No campo da Eletroquímica, são os dispositivos capazes de produzir corrente elétrica por meio de reações de oxirredução espontâneas. As baterias, que são a associação de duas ou mais pilhas para a produção de maior potência, são também exemplos de células galvânicas.
O nome “pilha” faz referência à primeira célula galvânica criada pelo italiano Alessandro Volta no final do século XVIII. Nesse sistema, discos de metais eram empilhados de forma alternada, separados por pedaços de tecido embebidos em solução de ácido sulfúrico, os quais permitiam o fluxo de elétrons entre os discos metálicos alternados.

Como funcionam as pilhas?
Uma pilha deve gerar energia elétrica. Porém, como? Para que exista energia elétrica, faz-se necessária a existência de corrente elétrica. Podemos entender corrente elétrica como, nada mais, nada menos do que cargas em movimento ordenado em um condutor elétrico, podendo ele ser sólido ou uma solução eletrolítica. Mas para que as cargas se movimentem dessa maneira, faz-se necessária a existência de uma diferença de potencial elétrico (ddp).
Pois bem, basicamente uma pilha tem a seguinte estrutura: dois eletrodos metálicos imersos em um condutor elétrico. A ddp em uma pilha é gerada por conta das reações de oxirredução. Em um dos eletrodos, elétrons são gerados por meio de reações de oxidação, criando um acúmulo de cargas negativas em um ponto da célula galvânica. É esse acúmulo de elétrons que cria uma disparidade de potencial elétrico dentro do sistema. Com a diferença de potencial, os elétrons migram ordenadamente para o outro eletrodo, acumulando-se na sua superfície e propiciando reações de redução. Esse processo continua até que a massa do eletrodo em que ocorreu a oxidação acabe, cessando assim a reação química.
Para ilustrar melhor o funcionamento de uma pilha, vamos utilizar a pilha de Daniell, desenvolvida pelo químico e físico britânico John Frederic Daniell em 1836.
Quando colocamos uma placa de zinco metálico em uma solução de sulfato de cobre II, que tem coloração azul, percebemos, depois de um tempo, a formação de um depósito metálico escuro sobre a superfície do zinco.

Investigando-se de forma melhor, percebe-se que tal depósito escuro é, na verdade, uma película de cobre metálico. Mas como isso pode ocorrer? Bem, a solução de sulfato de cobre II tem íons Cu2+ dispersos no meio, conforme mostra a equação de dissociação a seguir:
CuSO4 (aq) → Cu2+ (aq) + SO42– (aq)
A partir daí, ocorre uma reação de oxirredução espontânea, em que os íons de Cu2+ se reduzem a cobre metálico na superfície da barra de zinco. Contudo, para que ocorra a redução dos íons Cu2+, o zinco metálico simultaneamente se oxida a íons Zn2+, desprendendo-se da barra, gerando elétrons e então migrando para a solução no lugar dos íons Cu2+. Assim, esquematiza-se a reação de oxirredução como:
Zn (s) + Cu2+ (aq) → Zn2+ (aq) + Cu (s)
Percebe-se, então, que há transferência de elétrons do zinco para os íons Cu2+. Porém, caso essa transferência de elétrons ocorra por meio de um fio metálico, separando assim o zinco do cobre, teremos a criação de uma corrente elétrica. A pilha de Daniell, então, baseia-se nisso, como mostra a imagem a seguir:
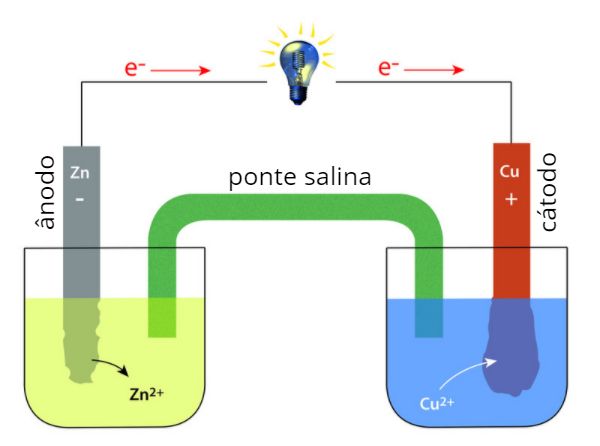
Na pilha representada, as mesmas reações antes descritas ocorrem. Porém, dessa vez, o eletrodo (placa) de zinco está imerso em uma solução de sulfato de zinco (ZnSO4), enquanto o eletrodo de cobre está imerso em uma solução de sulfato de cobre II (CuSO4). Essas soluções estão separadas, porém conectadas por um fio metálico condutor. O sistema é completado pela ponte salina, um tubo de vidro em U que contém uma solução salina com íons que não participam do processo.
Quando tudo está conectado, o zinco começa a se oxidar, transferindo os elétrons gerados para o fio metálico. Esses elétrons acumulam-se na superfície do eletrodo de cobre, atraindo assim os íons Cu2+ presentes na solução e, então, temos a redução deses íons na superfície metálica. Esse sistema gera uma diferença de potencial de 1,10 V (Volts), a qual é suficiente para acender uma pequena lâmpada. Ao perceber a lâmpada acesa, temos a certeza de que está tendo condução de corrente elétrica no sistema.
Com o passar do tempo, como o zinco metálico vai se transformando em Zn2+, podemos perceber que o eletrodo de zinco tem sua massa reduzida, ao passo que, como os íons Cu2+ vão se transformando em cobre metálico, podemos perceber que o eletrodo de cobre tem sua massa aumentada.
O eletrodo de zinco, local da pilha em que ocorre a reação de oxidação, é chamado então de ânodo. Já o eletrodo de cobre, local da pilha em que ocorre a reação de redução, é chamado de cátodo. Essa nomenclatura de ânodo e cátodo é muito utilizada em Eletroquímica, por isso seu conhecimento é essencial.
Leia também: Como medir os potenciais eletroquímicos?
Componentes de uma pilha
A pilha de Daniell é interessante, pois traz elementos muito importantes para entendermos o funcionamento desses dispositivos. Alguns componentes são básicos e nós falaremos sobre eles neste instante.
1. Eletrodos
Os eletrodos são, na maioria das vezes, peças metálicas, como barras ou chapas, em que ocorrerão as reações de oxidação e redução. Também existem eletrodos não metálicos, como é o caso da grafite, uma forma alotrópica do carbono. A grafite é um condutor de eletricidade e está presente nas pilhas alcalinas convencionais.
O eletrodo em que ocorre a reação de oxidação é chamado de ânodo (ou anodo), enquanto o eletrodo em que ocorre a reação de redução é chamado de cátodo (ou catodo).

2. Solução eletrolítica
Na pilha de Daniell, o eletrodo de zinco fica imerso em uma solução de sulfato de zinco, enquanto o eletrodo de cobre fica imerso em uma solução de sulfato de cobre II. Essas soluções são conhecidas como soluções eletrolíticas, pois nelas encontram-se íons livres, os quais também são chamados de eletrólitos. Por ter íons livres, a solução eletrolítica tem capacidade de condução de corrente elétrica, tal qual um fio metálico convencional.
3. Ponte salina
Na ausência da ponte salina, haveria um acúmulo de cátions na solução do ânodo, enquanto haveria uma falta de cátions na solução do cátodo. O excesso de cátions em solução do ânodo, por exemplo, atrairia os elétrons gerados, assim como a ausência de cátions na solução do cátodo causaria uma repulsão eletrônica no meio (por excesso de ânions) e, assim, não existira a manutenção do fluxo ordenado dos elétrons pelo fio condutor.
Assim, a ponte salina, contendo sempre uma solução eletrolítica com íons que não participam do processo, permite o fluxo de ânions e cátions entre as soluções, mantendo o circuito fechado, com as cargas balanceadas, e o pleno funcionamento da célula galvânica. Para saber mais sobre esse importante elemento, leia o texto: função da ponte salina em uma pilha.
Tipos de pilhas
A eletroquímica e o funcionamento das células galvânicas desencadearam o desenvolvimento de células mais modernas e com produtos mais otimizados para a nossa utilização no cotidiano.
Algumas células galvânicas são recarregáveis (pilhas e baterias recarregáveis), o que quer dizer que além de descarga, elas também podem acumular carga com auxílio de uma fonte de energia elétrica. Isso só é possível porque as reações de oxirredução são reversíveis, ou seja, enquanto na descarga a reação química ocorre em um sentido, na carga ocorre o processo contrário, com a regeneração dos reagentes. A seguir, algumas células galvânicas muito utilizadas em nosso cotidiano.
-
Pilhas secas
Foram desenvolvidas pelo francês George Leclanché e, por isso, também são conhecidas como pilha de Leclanché. São as pilhas mais comuns, utilizadas em brinquedos, lanternas, controles remotos e outros dispositivos eletrônicos.
É chamada de pilha seca porque a solução eletrolítica não é líquida, mas sim uma pasta que contém sais dissolvidos, como cloreto de amônio e cloreto de zinco. Essa pasta está envolta por uma capa de zinco, que constitui o ânodo da pilha e, no centro dessa pasta, temos um eletrodo de grafite com uma mistura de carvão em pó e dióxido de manganês em volta, que funciona como cátodo.
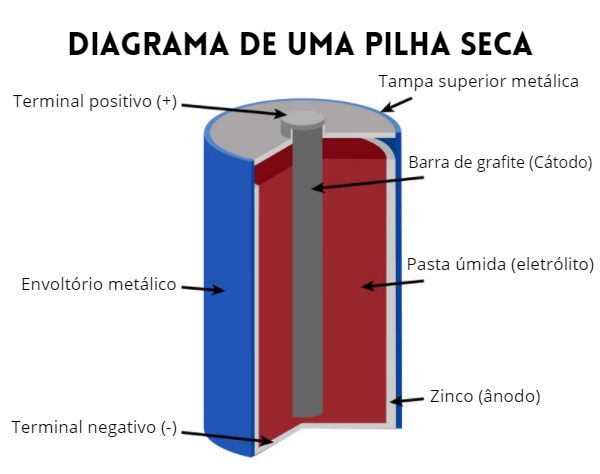
As pilhas secas convencionais não são recarregáveis, assim, quando todo o MnO2 for consumido, ela deixará de gerar corrente elétrica.
-
Pilha alcalina
As pilhas alcalinas funcionam da mesma forma que as pilhas secas, contudo são melhores, sendo então um aprimoramento. A principal diferença é a substituição de cloreto de amônio e cloreto de zinco por hidróxido de sódio.
Essa substituição evita a queda brusca de voltagem em seu funcionamento, pois, nas pilhas secas, há formação de uma camada isolante de cloreto de amônio em volta do grafite. Além disso, fornecem uma corrente de forma mais eficiente, além de terem maior vida útil.
-
Pilha de mercúrio
Nessa pilha, o ânodo é uma amálgama de zinco dissolvido em mercúrio, sendo o cátodo o óxido de mercúrio II, além de ter o hidróxido de potássio como solução eletrolítica.
Sua vantagem em relação às pilhas seca e alcalina é que a voltagem se mantém estável, não caindo com o tempo, como as duas anteriormente citadas. Comercializadas na forma de pequenos discos, são muito utilizadas em relógios, chaves de carro e controles remotos.

-
Baterias
No nosso dia a dia, é comum confundirmos pilhas com baterias. A maior diferença que se tem é que as baterias são pilhas associadas para que se adquira uma maior potência. Por exemplo, para se adquirir uma bateria de 9 V de tensão, é possível associar 6 pilhas de 1,5 V em série e, além disso, pode-se associar mais 6 pilhas de 1,5 V em paralelo com as 6 pilhas iniciais. Assim, a tensão se mantém, porém a corrente entregue é aumentada, bem como a potência da bateria. Alguns tipos de bateria são:
a) Ácido/chumbo
São as baterias automotivas, de 12 V, desenvolvidas pelo francês Raymond Gaston Planté, em 1859. Ela é feita por meio da associação em série de seis pilhas de 2 V, sendo o ânodo constituído por um grupo de placas de chumbo e o cátodo por uma série de placas de óxido de chumbo IV. O ácido sulfúrico funciona como solução eletrolítica nessa célula.

b) Níquel/cádmio
As baterias de níquel/cádmio (NiCd ou nicad) foram, por um tempo, as baterias recarregáveis mais comuns. Contudo, com o tempo, seu uso tem diminuído, não só porque tem problemas para acúmulo de carga, mas também porque “viciavam” com facilidade e o cádmio é um metal muito tóxico e poluente. Contudo, suas grandes vantagens são o preço e o tamanho e, por isso, ainda persiste no mercado.
Nessa bateria, ocorre a associação de duas pilhas de níquel-cádmio, em que o ânodo é formado por cádmio metálico, enquanto o cátodo é formado por um composto de níquel.

c) Hidreto metálico
São alternativas para as baterias de NiCd, em que o cádmio é substituído por um hidreto metálico, geralmente um hidreto de alumínio ou magnésio. Além de serem menos nocivas ao meio ambiente, seu desempenho é melhor que as baterias NiCd.
d) Íon lítio
São baterias recarregáveis com alta capacidade de armazenamento de energia. São muito comuns em celulares, notebooks, tablets e agora também nos carros elétricos. Nessas baterias, o cátodo é geralmente constituído por óxido de lítio-cobalto (LiCoO2), lítio-manganês (LiMn2O4) e lítio-níquel (LiNiO2) e o ânodo é constituído de grafite. O eletrólito é uma mistura de sais de lítio com compostos orgânicos adequados, adquirindo uma aparência de borracha, a qual é boa condutora de íons lítio (Li+).
Durante a carga dessa bateria, o metal associado ao lítio sofre oxidação, liberando os íons Li+ para a solução eletrolítica. Assim, migram para o eletrodo de carbono, onde se associam. No processo de descarga, ocorre justamente o contrário: os íons Li+ migram do eletrodo de grafite de volta para o cátodo.

Exercícios resolvidos sobre pilhas
Questão 1 – (Enem 2019) Grupos de pesquisa em todo o mundo vêm buscando soluções inovadoras, visando a produção de dispositivos para a geração de energia elétrica. Dentre eles, pode-se destacar as baterias de zinco-ar, que combinam o oxigênio atmosférico e o metal zinco em um eletrólito aquoso de caráter alcalino. O esquema de funcionamento da bateria zinco-ar está apresentado na figura.
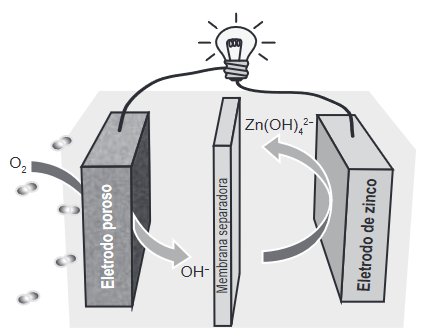
LI, Y.; DAI, H. Recent Advances in Zinc–Air Batteries. Chemical Society Reviews, v. 43, n. 15, 2014 (adaptado).
No funcionamento da bateria, a espécie química formada no ânodo é:
A) H2 (g).
B) O2 (g).
C) H2O (l).
D) OH– (aq).
E) Zn(OH)4– (aq)
Resolução
Alternativa E.
Ao observarmos o esquema de funcionamento da bateria zinco-ar, é possível perceber que, no eletrodo poroso, há a formação da espécie química OH–, enquanto, no eletrodo de zinco, há a formação da espécie química Zn(OH)4–.
Agora, faz-se necessário determinar qual dos dois eletrodos funciona como ânodo. Como é sabido, o ânodo é o eletrodo em que ocorre a oxidação, ou seja, aumento de carga (NOX) por conta da perda de elétrons.
No eletrodo poroso, o oxigênio inicia como O2, espécie em que o oxigênio tem NOX zero e termina como ânion OH–, espécie em que o oxigênio possui NOX igual a -2. Assim, podemos concluir que houve uma redução, sendo o eletrodo poroso o cátodo.
Já no eletrodo de zinco, o zinco está disposto na forma metálica, Zn, em que seu NOX é zero. Contudo, é produzida a espécie Zn(OH)4–, em que o zinco adquire NOX igual a +2. Assim, podemos concluir que houve uma oxidação, sendo o eletrodo de zinco o ânodo. Podemos então concluir que a alternativa correta é a de letra E.
Questão 2 - (Unifor 2007)
Observe o esquema abaixo.
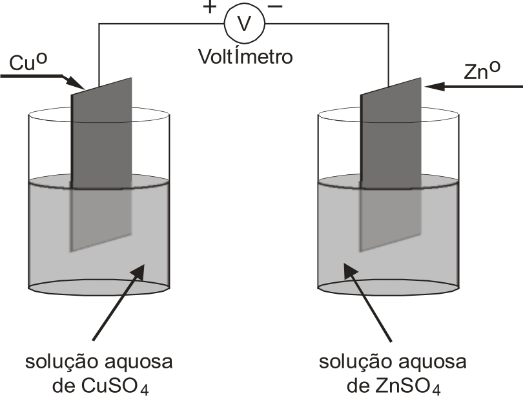
Para que esse conjunto funcione, ou seja, gere corrente elétrica, é necessário:
A) fechar o circuito elétrico através de uma solução saturada de KNO3.
B) inverter a posição das placas metálicas de cobre e zinco.
C) inverter a posição das soluções aquosas de CuSO4 e ZnSO4.
E) inverter os polos do voltímetro (medidor de tensão elétrica).
F) ligar os dois recipientes por meio de tubulação contendo água.
Resolução
Alternativa A.
Ao observar o esquema, percebe-se que estamos diante de uma pilha de Daniell. Contudo, como foi visto anteriormente, a pilha de Daniell não se mantém em funcionamento se não tiver o circuito fechado por uma ponte salina, um tubo de vidro que contenha uma solução eletrolítica com íons que não participam do processo.
Assim, para que o conjunto possa funcionar, faz-se necessária a colocação da ponte salina, algo que está descrito na letra A. Perceba que a solução utilizada é de nitrato de potássio, que contém íons diferentes dos utilizados na pilha.
Por Stéfano Araújo Novais
Professor de Química



