O que é pH? O pH é uma escala desenvolvida pelo dinamarquês Soren P. L. Sorensen, no ano de 1909. Ela serve para determinar, de forma simples e direta, os níveis de acidez de uma solução. É uma escala logarítimica e é inversamente proporcional à quantidade de íons H+ em solução. Numericamente, varia de 0 até 14.
O pH é extremamente importante para nosso corpo, metabolismo e meio ambiente. Praticamente todas as reações químicas que ocorrem no universo são dependentes do pH, e, por isso, conhecê-lo e controlá-lo é essencial. Organismos governamentais tentam regulamentar o pH de nossa água, e agricultores buscam um pH ideal para maximizar sua colheita.
Saiba mais: O que é uma solução química?
Tópicos deste artigo
- 1 - Resumo sobre o que é pH
- 2 - Escala de pH
- 3 - Como calcular o pH?
- 4 - Como medir o pH?
- 5 - Qual a importância do pH?
- 6 - Exercícios resolvidos sobre o que é pH
Resumo sobre o que é pH
-
O pH é uma escala que foi definida pelo dinamarquês Soren Peter Lauritz Sorensen no ano de 1909.
-
Serve para determinar os níveis de acidez de uma solução em função dos íons H+.
-
O pH é uma escala logarítimica, nunca negativa, que varia de 0 a 14.
-
Com valor entre 0 e 7, diz-se que o meio é ácido. Se o valor for igual a 7, então o meio é neutro. Já se o valor fica entre 7 e 14, então o meio é básico.
-
O pH é inversamente proporcional à concentração de íons H+ em solução.
-
O pH afeta diversos equilíbrios naturais, pois as reações químicas são, quase sempre, dependentes deste.
Escala de pH
A escala de pH, ou potencial hidrogeniônico, foi definida pelo químico dinamarquês Soren Peter Lauritz Sorensen no ano de 1909. Ela serve para determinar os níveis de acidez de uma solução (diretamente proporcionais à concentração dos íons hidrogênio, H+, ou hidrônio, H3O+).
Quando desenvolveu tal escala, Sorensen era o químico chefe dos laboratórios da cervejaria Carlsberg. Com objetivo de aprimorar a qualidade de seu produto e estudando fermentação, o químico dinamarquês desenvolveu a escala.
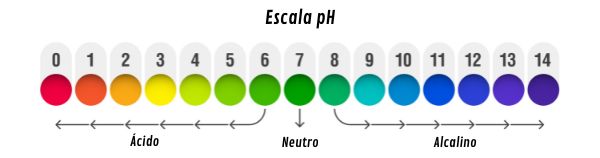
A escala de pH varia de 0 a 14, sendo:
-
pH < 7: solução ácida; concentração de íons H+ maior que 1,0 x 10-7 mol.L-1.
-
pH = 7: solução neutra; concentração de íons H+ igual a 1,0 x 10-7 mol.L-1.
-
pH > 7: solução alcalina (ou básica); concentração de íons H+ menor que 1,0 x 10-7 mol.L-1.
Como calcular o pH?
O pH pode ter seu valor calculado da seguinte forma:
pH = –log[H+]
Dessa forma, percebe-se que quanto maior o valor da concentração de H+ ([H+]), menor o valor do pH, ou seja, quanto mais ácida a solução, menor o pH.
Definir a acidez em uma escala logarítimica foi muito positivo. Primeiro que, em solução, os valores de íons hidrogênio podem variar drasticamente, além de serem, na maioria das vezes, expressos em potências negativas de 10.
Ao trabalhar com a escala logarítimica, os valores mantiveram-se sempre positivos, e as variações medidas são mais brandas, já que para o pH aumentar uma unidade, a acidez (concentração de íons hidrogênio) deve cair 10 vezes.
-
Exemplo:
Calcule o pH de uma solução cuja [H+] é igual a 1,0 x 10-3 mol.L-1
Resolução:
pH = –log(1,0 x 10-3)
pH = – [log(1,0) + log(10-3)]
pH = – [0 + (-3).log(10)]
pH = – (-3).(1)
pH = 3
Importante: Em soluções básicas, é comum serem apresentados os valores do íon OH-. Nesse caso, com essa informação, calcula-se o pOH, cuja expressão é idêntica:
pOH = –log[OH-]
Contudo, o pH pode se relacionar com o pOH da seguinte forma:
pH + pOH = 14
-
Videoaula sobre cálculo de pH e pOH
Como medir o pH?
Nos dias atuais, alguns instrumentos de laboratório podem servir para aferir o valor de pH em solução.
Para análises rápidas e sem muito rigor, é comum que os químicos utilizem fitas de pH, uma vez que são de fácil acesso e de baixo custo. Elas mudam de cor de acordo com o pH do meio e dão uma boa noção da acidez ou alcalinidade do meio.
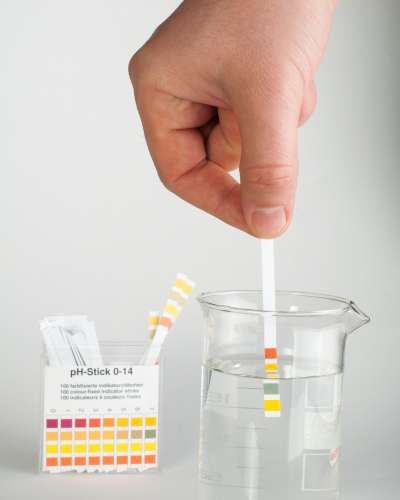
Porém, para análises com maior rigor quantitativo, utilizam-se aparelhos chamados de pHmetros. Tais aparelhos são calibrados e possuem um eletrodo conectado a um potenciômetro, o qual permite a conversão do valor de potencial medido para o eletrodo em unidades de pH.

Qual a importância do pH?
As medidas de pH são importantes para diversos setores. Reações químicas podem se desenvolver de forma diferente de acordo com o pH do meio, já que ácidos ou bases fracos tendem a estar mais ou menos ionizados de acordo com o valor do pH.
O funcionamento do corpo humano é totalmente dependente do pH. As enzimas, por exemplo, possuem um pH ideal para sua atividade. É o exemplo da pepsina, produzida pelas paredes do estômago e que só reage em meio ácido. É por isso que em nosso estômago há o suco gástrico, cujo pH fica entre 1,0 e 3,0.
O sangue humano também deve apresentar um pH ótimo, levemente alcalino, entre 7,35 e 7,45. Excessos de acidez ou de alcalinidade no sangue podem impedir o bom funcionamento do nosso organismo. Pacientes com acidose sanguínea, por exemplo, apresentam sintomas como palpitação, vômito e sonolência, enquanto os pacientes com alcalose podem apresentar fraqueza, dores de cabeça e espasmos musculares.
Tem também grande importância o pH na agricultura. O solo deve apresentar um pH próximo da neutralidade, entre 5,5 e 6,5, condição em que os nutrientes possuem maior disponibilidade.
O pH das águas também deve ser monitorado, pensando-se na vida dos seres marinhos. Em maiores níveis de acidez, os peixes apresentarão maior frequência respiratória, passando a abocanhar o ar na superfície e, caso a acidez seja muito elevada, pode ocasionar mortandade. Valores alcalinos de pH podem ocasionar a formação do óxido de cálcio, o que provoca a corrosão do epitélio braquial e nadadeiras dos peixes, levando-os à morte.
A resolução 357/05 do Conselho Nacional do Meio Ambiente (Conama) estabelece pH entre 6,0 e 9,0 para águas doces e entre 6,5 e 8,5 para águas salinas, sendo que nesse caso não deve haver uma mudança do pH natural maior que 0,2 unidade. Já a resolução 430/11 complementa e altera a resolução 357/05, ao instituir que os efluentes de qualquer fonte poluidora devem ser lançados com pH entre 5 e 9.
Saiba também: O que é NOX?
Exercícios resolvidos sobre o que é pH
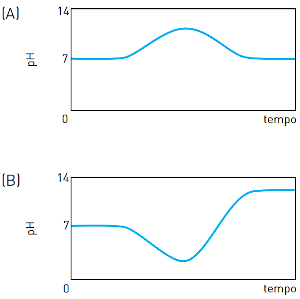
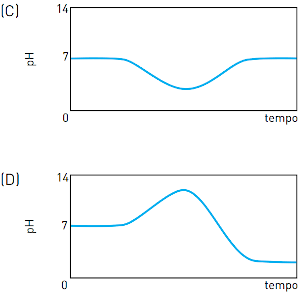
(Uerj 2013) Em um reservatório contendo água com pH igual a 7, houve um descarte acidental de ácido sulfúrico. Em seguida, foi adicionada uma determinada substância de caráter básico, em quantidade suficiente para neutralizar a acidez. O gráfico que representa o comportamento do pH durante esse processo é:
Resolução:
Alternativa C
Ao avaliar o contexto, percebe-se que o pH, inicialmente 7, teve seu valor diminuído por conta do ácido sulfúrico (quanto maior a acidez, menor o pH). Depois, coloca-se uma substância básica capaz de neutralizar a acidez anterior e, por isso, o pH retorna ao estágio inicial, cujo valor é 7.
Questão 2
(Uerj 2017) Indicadores ácido-base são substâncias que, ao serem adicionadas a soluções aquosas, modificam sua coloração de acordo com o pH do meio. Observe a seguir a variação de cor proporcionada por quatro indicadores em função do pH.
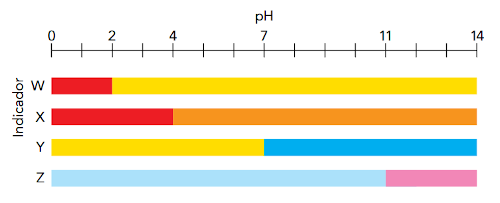
Considere o preparo em laboratório de duas soluções aquosas de NaOH com concentrações de 10−2 mol.L−1 e 10−6 mol.L−1, a 25 °C. É possível diferenciar visualmente essas soluções com a adição do seguinte indicador:
A) W
B) X
C) Y
D) Z
Resolução:
Alternativa C
O NaOH é uma monobase, assim, quando em solução, a quantidade de mols de íons OH- é igual à quantidade de NaOH. Por isso, as concentrações de NaOH são as mesmas para os íons OH-. Com tais concentrações, calcula-se o pOH. O pH pode ser calculado por meio da expressão
pH + pOH = 14
Para a concentração 10-2 mol.L-1:
pOH = –log(10-2)
pOH = -(-2)log10
pOH = 2; logo, nesse caso, o pH é igual a 12.
Para a concentração 10-6 mol.L-1:
pOH = –log(10-6)
pOH = -(-6)log10
pOH = 6; logo, nesse caso, o pH é igual a 8.
Assim, deve-se escolher um indicador cuja cor em pH 8 seja diferente em pH 12. O indicador que obedece a tal critério é o Z.
Por Stéfano Araújo Novais
Professor de Química


