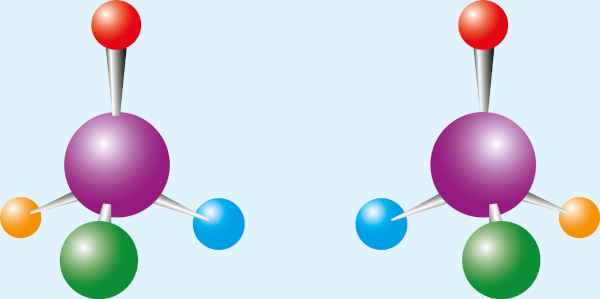
A isomeria é um importante fenômeno que ocorre na Química, em que dois ou mais compostos apresentam a mesma fórmula molecular. Quando apresentam essa condição, os compostos são chamados de isômeros. É algo que pode ocorrer tanto em Química Orgânica quanto na Químca Inorgânica.
Existem dois tipos de isomeria: a plana (ou constitucional), em que a diferença entre os isômeros se dá pela avaliação da fórmula estrutural plana, e a espacial, em que é preciso avaliar o arranjo tridimensional das moléculas. Os isômeros diferem em propriedades químicas e físicas.
Leia também: Alotropia — capacidade de um elemento químico formar duas ou mais substâncias simples diferentes
Tópicos deste artigo
- 1 - Resumo sobre isomeria
- 2 - O que é isomeria?
- 3 - Tipos de isomeria
- 4 - Exemplos de isomeria
- 5 - Nomenclatura da isomeria
- 6 - Exercícios resolvidos sobre isomeria
Resumo sobre isomeria
- A isomeria é um importante fenômeno que ocorre na Química, em que dois ou mais compostos apresentam a mesma fórmula molecular.
- Ocorre tanto na Química Orgânica quanto na Química Inorgânica.
- A isomeria plana (ou constitucional) ocorre quando a diferença dos isômeros é perceptível pela avaliação das fórmulas estruturais.
- Entre os tipos de isomeria plana estão a de função, cadeia, posição, compensação e tautomeria.
- Quando a diferença entre os isômeros é perceptível apenas via avaliação do arranjo espacial dos átomos, estamos diante de casos de isomeria espacial.
- Dentro da isomeria espacial estão a isomeria cis-trans e a isomeria óptica.
O que é isomeria?
A isomeria é um fenômeno que ocorre quando duas ou mais espécies possuem a mesma fórmula molecular, mas possuem fórmulas estruturais diferentes e, assim, diferentes propriedades físicas e/ou químicas, chamadas de isômeros. Embora não seja um fenômeno exclusivo da Química Orgânica, sendo também possível, por exemplo, nos compostos de coordenação da Química Inorgânica, a isomeria é de extrema importância no estudo dos compostos orgânicos.
Tipos de isomeria
- Isomeria plana (constitucional): a diferença entre os isômeros é perceptível por meio de uma avaliação das fórmulas estruturais planas.
- Isomeria espacial (estereoisomerismo): a diferença entre os isômeros é perceptível pela avaliação do arranjo espacial dos átomos. É subdividida em:
- Isomeria cis-trans: possível apenas em alcenos ou cicloalcanos, e as diferenças entre os isômeros são avaliadas por meio da diferença da posição dos átomos em relação a um plano de referência. Também conhecida como isomeria geométrica, embora o termo esteja em desuso pela Iupac.
- Isomeria óptica: isomeria espacial em que as substâncias diferem quanto à atividade óptica, em decorrência da presença de um carbono quiral (assimétrico).
Exemplos de isomeria
→ Exemplos de isomeria plana
Dentro da isomeria plana existem diversas categorias de isomeria, que fazem referência direta a como diferem na fórmula estrutural plana.
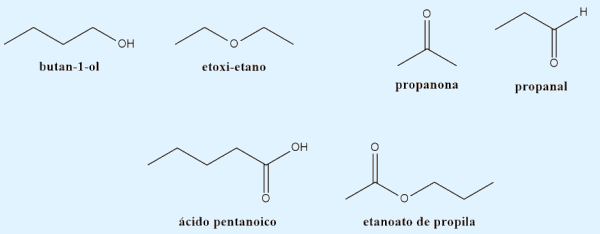
- Função: os isômeros planos possuem função orgânica diferente.
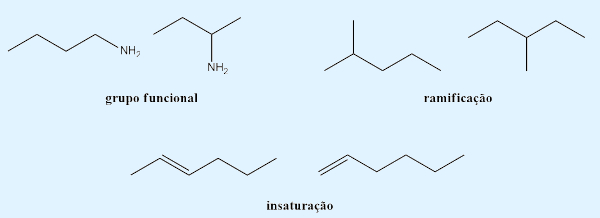
- Posição: os isômeros planos possuem diferença na posição de um grupo de interesse dentro da fórmula estrutural plana, seja de um grupo funcional, de uma instauração ou de uma ramificação.
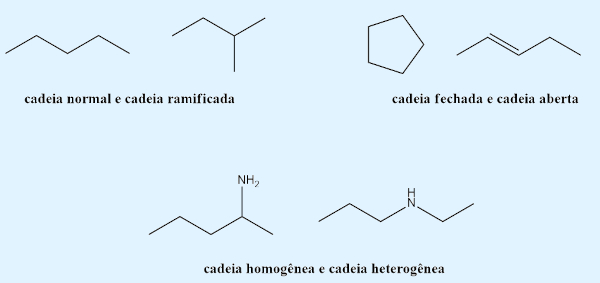
- Cadeia: os isômeros planos possuem diferença no tipo da cadeia.
- Compensação: os isômeros possuem alteração na cadeia em torno de um heteroátomo.

- Tautomeria: os isômeros (chamados de tautômeros) coexistem no meio reacional, apresentando efeito de interconversão (um isômero se converte em outro).
→ Exemplos de isomeria cis-trans (geométrica)
No caso da isomeria cis-trans, deve-se identificar o plano de referência, que consiste em um ponto da estrutura em que não possa haver rotação livre da ligação carbono-carbono, que pode ser tanto uma ligação dupla em um alceno quanto em uma ligação simples em um cicloalcano.
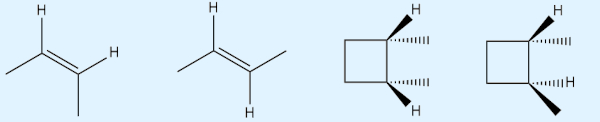
Não havendo rotação livre da ligação carbono-carbono, a mudança da posição dos átomos ligantes origina compostos com propriedades físicas e químicas diferentes.
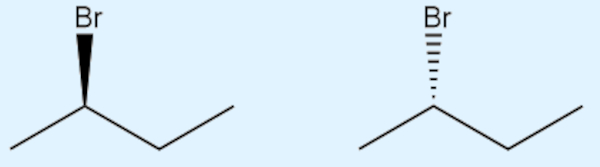
→ Exemplos de isomeria óptica (geométrica)
A presença de um carbono quiral (ou assimétrico) na molécula origina duas estruturas, as quais não são sobreponíveis (como a sua mão esquerda não sobrepõe a sua mão direita) e, por isso, são diferentes em termos de propriedades químicas e na sua relação com o plano da luz polarizada.
Nomenclatura da isomeria
Os únicos casos de isomeria em que há uma nomenclatura diferenciada são os isômeros espaciais (cis-trans e ópticos). A Iupac recomenda a utilização dos chamados estereodescritores, que são prefixos que fazem referência à conformação espacial das moléculas.
Para a isomeria cis-trans, os estereodescritores mais usados são justamente os prefixos “cis” e “trans”, que devem ser usados, segundo a Iupac, quando existe um átomo de hidrogênio em cada carbono da ligação. Dessa forma, quando os dois átomos de hidrogênio estão para o mesmo lado da ligação carbono-carbono, diz-se que é um isômero cis; do contrário, caso os dois átomos de hidrogênio estejam para lados opostos da ligação carbono-carbono, diz-se que é um isômero trans.
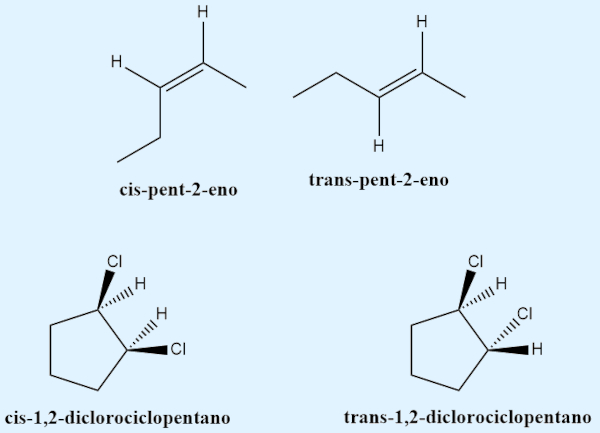
Quando não há dois átomos de hidrogênio, a Iupac determina a utilização da regra de CIP (Cahn-Ingold-Prelog) para determinar os ligantes de maior ordem em cada carbono da ligação. A prioridade, segundo a regra de CIP, se dá pelo número atômico (Z, o número de prótons no núcleo). Caso os ligantes de maior ordem estejam para o mesmo lado, deve-se utilizar o estereodescritor “Z” (do alemão zusammen, que significa “juntos”). Se os ligantes de maior ordem estiverem em lados opostos da ligação carbono-carbono, deve-se utilizar o estereodescritor “E” (do alemão entgegen, que significa “opostos”).
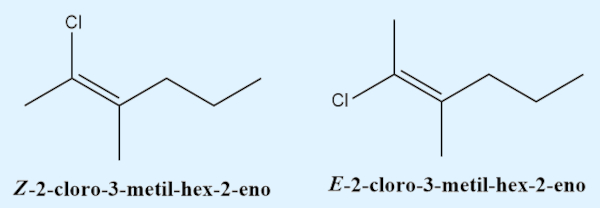
Contudo, é comum ver alguns autores não utilizando essa obrigação de dois átomos de hidrogênio prevista pela Iupac para utilizar os estereodescritores “cis” e “trans”, generalizando para todos os casos e, assim, tornando “cis” um sinônimo para “Z” e “trans” um sinônimo para “E”.
No caso da isomeria óptica, cada carbono quiral dá origem a um par de isômeros, conhecidos como enantiômeros. Cada enantiômero tem a capacidade de desviar o plano da luz polarizada para uma direção. Os enantiômeros que desviam o plano da luz polarizada para a esquerda são chamados de levogiros, enquanto os que desviam o plano da luz polarizada para a direita são chamados de dextrogiros.
Porém, diferentemente da isomeria cis-trans, a determinação de qual enantiômero é levogiro ou dextrogiro se dá apenas por métodos experimentais e, assim sendo, não há como, pela simples avaliação da estrutura, determinar de qual enantiômero se trata. Uma vez determinados, entretanto, deve-se utilizar o estereodescritor “l” ou “−” para o isômero levogiro e o estereodescritor “d” ou “+” para o isômero dextrogiro.
Exercícios resolvidos sobre isomeria
Questão 1
(Uerj) A flor do jasmim é popular no Brasil, sendo admirada por sua beleza e aroma agradável. Os principais compostos responsáveis por seu aroma estão representados a seguir.
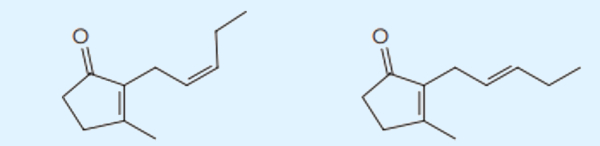
Analisando as fórmulas estruturais desses compostos, identifica-se que a isomeria espacial existente entre eles é a denominada:
A) óptica
B) de cadeia
C) de posição
D) geométrica
Resolução:
Alternativa D.
Percebe-se uma variação da ordenação posição dos grupos ligantes em torno da ligação dupla, caracterizando uma isomeria geométrica. Não é óptica, pois não há carbono quiral. Não é de cadeia, pois o tipo de cadeia é o mesmo, e as ramificações e a insaturação estão ligadas ao mesmo carbono, excluindo-se a hipótese de isomeria de posição.
Questão 2
(Uerj) Em uma unidade industrial, emprega-se uma mistura líquida formada por solventes orgânicos que apresentam a fórmula molecular C2H6O.
Entre os componentes da mistura, ocorre isomeria plana do seguinte tipo:
A) cadeia
B) função
C) posição
D) compensação
Resolução:
Alternativa D.
Com o quantitativo de 2 carbonos não é possível fazer isômeros planos de posição, cadeia ou compensação. Assim sendo, a resposta é isomeria de função, mais especificamente os isômeros etanol e metoximetano.
Fontes
BRUICE, P. Y. Organic Chemistry. 8. ed. Upper Saddle River, Nova Jersey: Pearson Education Inc., 2015.
FAVRE, H. A.; POWELL, W. H.; MOSS, G. P. Nomenclature of Organic Chemistry. IUPAC Recommendations and Preferred Names 2013. Londres: Royal Society of Chemistry, 2013.
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. GoldBook – Compendium of Chemical Terminology. Disponível em: https://goldbook.iupac.org/.
SOLOMONS, T. W. G.; FRYHLE, C. B.; SNYDER, S. A. Química Orgânica: volumes 1 e 2. 12. ed. Rio de Janeiro: LTC, 2018.