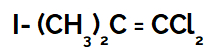Isômeros são compostos que possuem a mesma fórmula molecular, mas se diferenciam na fórmula estrutural.
Na Isomeria espacial a diferença das fórmulas estruturais só é perceptível através da análise espacial da molécula. Há dois tipos de isomeria espacial: geométrica (cis-trans ou Z-E) e óptica.
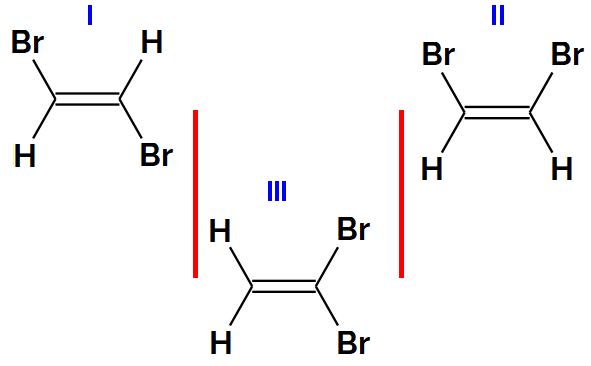
• Isomeria geométrica: os compostos abaixo são classificados como isômeros geométricos em virtude de suas estruturas espaciais. Só é possível perceber essa isomeria se considerarmos as moléculas num plano imaginário, veja como:
Isômero Cis Isômero trans
As ramificações – Cl (na cor verde) estão em posições diferentes na molécula: no isômero cis, elas se posicionam do mesmo lado, e no isômero trans, ocupam lados opostos.
Repare que os isômeros possuem a mesma fórmula molecular como também a mesma fórmula estrutural plana, tendo como fator de diferenciação apenas a fórmula estrutural espacial.
Veja mais um exemplo:
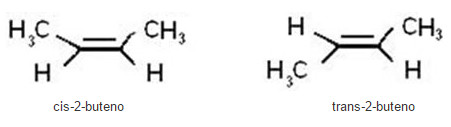
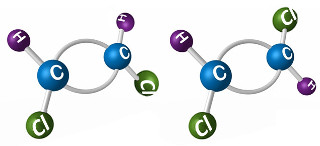
• Isomeria óptica: está associada ao comportamento das substâncias submetidas a um feixe de luz polarizada obtida quando a luz natural, não polarizada, atravessa um polarizador.
Essa definição “um tanto quanto complicada” traduz a ideia de que algumas substâncias têm a propriedade de desviar o plano de vibração da luz polarizada, elas são, por isso, denominadas de isômeros ópticos.
Como o desvio do plano de vibração pode ocorrer em dois sentidos, temos a classificação:
Isômero dextrogiro (d): desvio para o lado direito
Isômero levogiro (l): desvio para o lado esquerdo
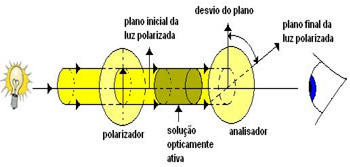
Aparelho polarímetro: análise de uma amostra dextrogira.
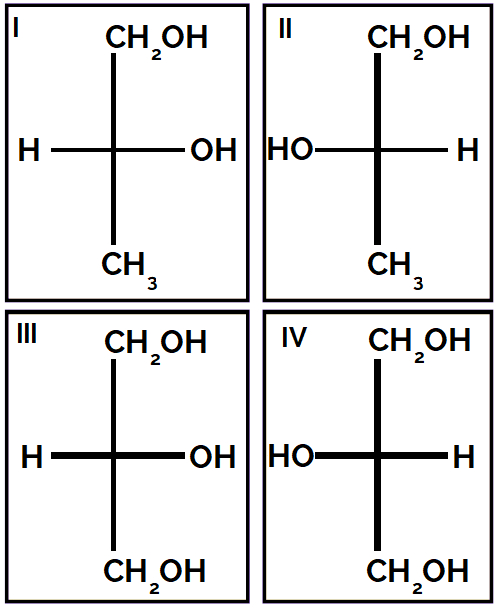
Exemplo de isômeros ópticos: ácidos lácticos
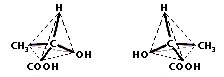
Ácido levoláctico Ácido dextroláctico
Ambos provocam o mesmo desvio angular, porém em sentidos opostos. Ao olharmos estas duas estruturas vemos que são fisicamente iguais, mas fisiologicamente e quimicamente são diferentes. Como se faz a distinção entre elas? Como se tratam de isômeros opticamente ativos usamos a classificação dextrogiro e levogiro. As letras “d e l” são usadas na nomenclatura:
Ácido levoláctico → ácido l-láctico: presente na fermentação de açúcares.
Ácido dextroláctico → ácido d-láctico: presente nos músculos.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
Veja mais!
Isomeria plana
Polaridade dos compostos orgânicos
Isomeria - Química Orgânica - Química - Brasil Escola