No texto “Isomeria geométrica ou cis-trans” foi mostrado como ocorre a isomeria espacial geométrica ou cis-trans. Resumidamente, o isômero cis corresponde aos compostos cujos ligantes iguais em cada átomo de carbono estão num mesmo plano; já no isômero trans, eles estão em lados opostos.
Isso é identificado pela origem desses termos, que vem do latim, onde cis significa “próximo a” e trans “através de”.
Essa nomenclatura é bastante útil quando dois carbonos possuem cada um apenas dois ligantes diferentes. No entanto, esses termos podem se apresentar ambíguos quando nos referimos a alcenos, cujos átomos de carbono da ligação dupla possuam mais que dois ligantes diferentes no conjunto.
Por exemplo, considere o composto abaixo:
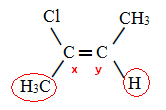
Observe que no carbono x o ligante de menor número atômico é o CH3, e no carbono y é o H. Mas, se colocássemos que esse composto é o isômero cis, poderia surgir a seguinte dúvida: como ele é cis se os grupos ligantes iguais (CH3) estão em lados opostos?
Portanto, para evitar essa ambiguidade, é mais correto usar nesses casos a nomenclatura E-Z, onde a letra E vem da palavra alemã entgegen, que significa “opostos” e Z vem da palavra alemã zusammen, que quer dizer “juntos”. Essa nomenclatura segue a seguinte regra:
.jpg)
Aplicando essa regra de prioridade para o 2-clorobu-2-eno, temos que no carbono x o ligante de maior número atômico é o Cl, e no carbono y é o CH3. Assim, temos os seguintes isômeros:
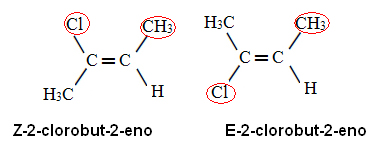
No primeiro caso, os ligantes de maiores números atômicos estão do mesmo lado do plano (Z) e no segundo, eles estão em lados opostos (E).
Isso ocorre também com os compostos cíclicos. É importante lembrar que não é correto se relacionar os termos cis e Z, e trans e E, pois são sistemas de nomenclatura diferentes.
Por Jennifer Fogaça
Graduada em Química

.jpg)
.jpg)
.jpg)
.jpg)
.jpg)