A luz polarizada foi observada pela primeira vez em 1808 por Malus e Huygens, ao observar um feixe de luz atravessar o espato da Islândia, um cristal transparente de uma variedade de carbonato de cálcio.

Em 1812, Jean-Baptiste Biot observou que o feixe de luz polarizada era rotacionado, em alguns cristais, para a direita e, em outros, para a esquerda. Uma importante observação que ele fez foi a de que não eram apenas substâncias sólidas, ou líquidos puros que rotacionavam o feixe de luz polarizada, mas até mesmo soluções aquosas de determinadas substâncias orgânicas tinham essa propriedade. Isso indicava que o fenômeno observado era decorrente da estrutura da molécula em si.
Biot inventou um aparelho para observar o fenômeno do desvio do plano da luz polarizada, que ficou conhecido como polarímetro. Em 1842, ele foi aperfeiçoado por Ventzke, que adaptou um prisma de Nicol ao aparelho, e, anos mais tarde, Mitscherlich introduziu o uso de luz monocromática nas observações.
Mas, foi somente em 1846 que esse fenômeno foi explicado, por meio dos estudos de Louis Pasteur, que foi aluno de Biot. Durante o processo de fermentação do suco de uva, para a produção do vinho, formam-se dois ácidos: o ácido tartárico e o ácido racêmico.

Selo impresso pela Central Africano República mostra Louis Pasteur (1822-1895), Químico e Microbiologista, por volta de 1985*
Esses dois ácidos possuíam a mesma fórmula molecular e as mesmas propriedades, porém, apresentavam um comportamento diferente quando submetidos ao feixe de luz polarizada. Já se sabia que o ácido tartárico era opticamente ativo, rotacionando o plano de luz polarizada para a direita. Já os sais do ácido racêmico eram inativos sob a luz polarizada.
Pasteur descobriu que enquanto o ácido tartárico era composto apenas de um tipo de molécula, o ácido racêmico possuía dois tipos. Estudando cuidadosamente os sais que formavam ambos os ácidos, Pasteur descobriu que os cristais do ácido tartárico eram assimétricos e os do ácido racêmico também. Porém, alguns cristais desse último tinham uma face diferente para a direita e outros para a esquerda.
Ele separou cuidadosamente esses cristais e dissolveu-os separadamente em água. Depois de analisar essas soluções, ele descobriu que ambas eram opticamente ativas. Portanto, o ácido racêmico não era puro, na verdade, ele era composto por metade de um tipo de ácido tartárico dextrogiro (que desvia o plano de polarização para a direita) e a outra metade do tipo de ácido tartárico levogiro (que desvia o plano de polarização para a esquerda). Visto que esse dois tipos provocavam um desvio de mesmo valor, mas com sentido contrário, um acabava anulando o outro e a substância se tornava inativa opticamente.
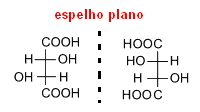
Assim, quando uma molécula possui carbonos assimétricos, como é o caso do ácido tartárico, ela dá origem a dois isômeros ópticos, de mesma fórmula molecular, mas com atividades ópticas diferentes.
* Créditos da imagem: rook76 e Shutterstock.com
Por Jennifer Fogaça
Graduada em Química

