A Esteroisomeria, também conhecida como Isomeria Espacial, é um tipo de isomeria em que seus isômeros se diferenciam pelas ligações entre seus átomos estarem dispostas de forma diferente no espaço.
Existem dois tipos de estereoisômeros, os diastereoisômeros e os enantiômeros. Os diastereoisômeros são os isômeros geométricos do tipo cis-trans, que não são a imagem especular um do outro, já os enantiômeros são isômeros ópticos que são a imagem especular um do outro.
Falando um pouco sobre a diastereoisomeria cis-trans, ela só ocorre em compostos que sejam insaturados ou que sejam cíclicos. Por que ela não ocorre em compostos de cadeia saturada, isto é, que possuem apenas ligações simples entre carbonos?
Pode ocorrer de nos confundirmos, achando que determinados compostos saturados são diastereoisômeros, quando na verdade representam o mesmo composto. Por exemplo, a seguir, temos três conformações espaciais dos átomos do 1,2-dicloroetano:
H H H H H Cl
│ │ │ │ │ │
H — C — C — H H — C — C — Cl H — C — C — H
│ │ │ │ │ │
Cl Cl Cl H Cl H
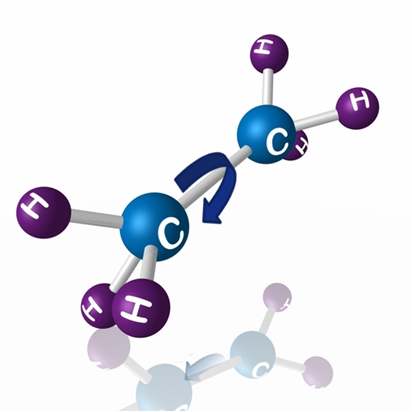
Será que esses três são diastereoisômeros? Não. Na verdade, as três moléculas são do mesmo composto. O que ocorre é que a ligações simples ou sigma (σ) entre os carbonos podem sofrer rotações, resultando em diferentes arranjos atômicos.
Veja como isso acontece no esquema abaixo com o etano:
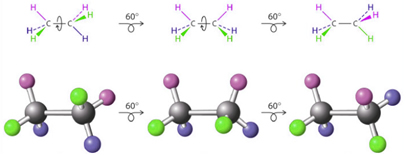
Esses compostos, que na verdade são o mesmo composto, não realizam isomeria geométrica cis-trans, mas são denominados de isômeros conformacionais, pois se diferem somente pela conformação de seus átomos causada pela rotação em torno da ligação simples.
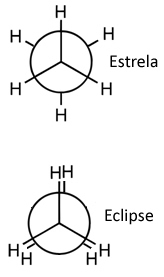
Umas das formas de se representar essas moléculas para ficar fácil de visualizar a rotação do eixo da ligação é por meio da projeção de Newman, em que se considera como se o plano de visão fosse exatamente no eixo da ligação entre os carbonos e eles são representados por um círculo central. Veja a projeção de Newman para o etano:
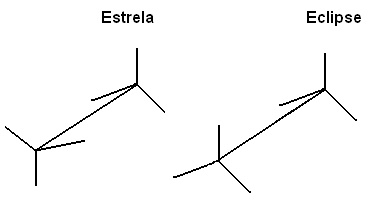
Também podemos representar essas diferentes conformações por meio da fórmula em cavaletes:
Essa livre rotação do eixo da ligação já não ocorre em compostos insaturados e nem em cíclicos. Por exemplo, imagine que construíssemos um modelo simples, representando dois carbonos por duas bolas de isopor ligadas por um palito de dentes enfiado nelas.
Quando temos um só palito e seguramos uma das bolas, a outra pode girar em torno de seu próprio eixo facilmente, assim como ocorre com a ligação simples.
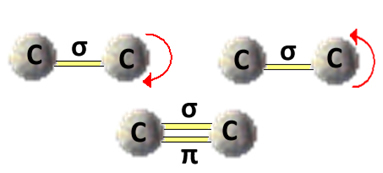
No entanto, se colocarmos mais um palito de dentes ligando as duas esferas, não conseguiremos segurar uma esfera e girar a outra. Se fizermos isso, os palitos quebrarão. Da mesma forma, quando há uma ligação pi e uma sigma (dupla ligação) ocorre um impedimento da rotação dos carbonos.
Portanto, no caso abaixo, em que temos uma ligação dupla entre os carbonos, não se trata de dois isômeros conformacionais, ou seja, duas conformações para uma mesma molécula; na realidade, temos dois diastereoisômeros cis-trans:
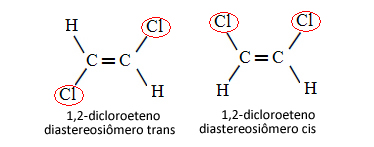
Veja mais sobre esse tipo de isomeria no texto Isomeria geométrica ou cis-trans.
Por Jennifer Fogaça
Graduada em Química