O ozônio (O3) é uma forma alotrópica do elemento químico oxigênio. Em condições ambiente, apresenta-se como um gás. É reconhecido pela sua alta reatividade, grande poder oxidante e desinfetante. É formado naturalmente em camadas superiores da atmosfera (estratosfera) após fotodecomposição de moléculas de gás oxigênio.
Esse gás é empregado como oxidante e desinfetante, principalmente no tratamento de águas. Tenta-se avaliar sua eficiência em tratamentos clínicos, como no caso da ozonioterapia. Contudo, o ozônio é tóxico para as plantas e altamente nocivo para nosso sistema respiratório. A camada de ozônio é um importante mecanismo de defesa de nosso planeta, pois filtra as radiações eletromagnéticas de alta energia, nocivas à nossa saúde.
Leia também: Aquecimento global — o aumento anormal da temperatura média do planeta
Tópicos deste artigo
- 1 - Resumo sobre o ozônio
- 2 - O que é ozônio?
- 3 - Características do ozônio
- 4 - Propriedades do ozônio
- 5 - Formação do ozônio
- 6 - Para que serve o ozônio?
- 7 - Perigos do ozônio
- 8 - Camada de ozônio
Resumo sobre o ozônio
- O ozônio, O3, é uma forma alotrópica do oxigênio
- Em condições ambiente, se apresenta na forma gasosa.
- Possui grande reatividade, sendo um bom oxidante, porém termicamente instável.
- Ocorre naturalmente em camadas superiores da atmosfera.
- Sua principal forma de produção é por ação da fotodecomposição do gás oxigênio.
- O ozônio é empregado no tratamento de águas, por conta de seu poder de oxidação e desinfecção.
- Estudos tentam comprovar a eficiência do ozônio na medicina, a chamada ozonioterapia.
- O ozônio é fitotóxico e pode ser muito nocivo ao nosso sistema respiratório.
- A camada de ozônio é um importante mecanismo de defesa de nosso planeta, pois ela serve para diminuir a incidência de radiações eletromagnéticas de alta energia em nossa superfície.
O que é ozônio?
O ozônio, de fórmula molecular O3, é uma forma alotrópica do oxigênio. Em condições ambiente, apresenta-se na forma gasosa e é reconhecido por sua grande reatividade, sendo termicamente instável e explosivo em qualquer estado de agregação (sólido, líquido ou gasoso). Tem um odor pungente que pode ser detectado a partir de concentrações de 0,01 ppm (parte por milhão) no ar.
Ocorre naturalmente na estratosfera (que fica de 15 a 50 km acima da superfície terrestre), em concentrações de 1 a 10 ppm. Sua produção se dá pela ação da radiação solar sobre as moléculas de gás oxigênio, O2, outro alótropo do elemento oxigênio.
Características do ozônio
Diferentemente do gás oxigênio, o ozônio é uma molécula angular, cujo ângulo da ligação é de 117°, com um comprimento de 127,8 pm (picômetro, 10-12 m) e também de caráter levemente polar. O ozônio é um híbrido de três estruturas de ressonância, demonstradas a seguir.
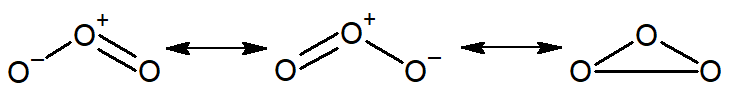
O ozônio reage rapidamente com diversos radicais livres, sendo que alguns, como os radicais HO•, NO•, Cl• e Br•, são capazes de iniciar a sua decomposição catalítica.
Em comparação ao O2, o O3 é muito mais reativo, destacando-se o seu grande potencial oxidativo. A seguir, estão dispostas algumas reações em que o ozônio atua como agente oxidante.
O3 + S + H2O → H2SO4
O3 + Br- → O2 + BrO-
4 O3 + NH3 → H+ + NO3- + H2O + 4 O2
De fato, o seu poder oxidante é muito conhecido. Praticamente todos os metais conseguem ser oxidados pelo ozônio, com exceção do ouro e dos metais do grupo da platina (paládio, ródio, rutênio, irídio, ósmio e a própria platina). Na Química Orgânica, é muito conhecida a reação de ozonólise de alcenos, em que podem ser formados aldeídos ou cetonas, a depender do grau de substituição dos carbonos da insaturação. O mecanismo da reação é mostrado a seguir.
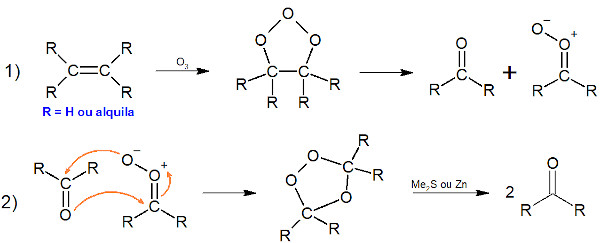
Na última etapa, ocore a redução por ação de zinco metálico ou dimetilsulfureto (DMS ou Me2S) para a formação do aldeído ou da cetona. Sendo usado o zinco metálico, o subproduto inorgânico é o ZnO; sendo usado o DMS, o subproduto é o dimetilsulfóxido (DMSO, Me2SO).
Leia também: Reações orgânicas — os tipos de processos de transformação de moléculas orgânicas
Propriedades do ozônio
Em condições ambiente, o ozônio é um gás de coloração azul bem pálida, de densidade 2,14 g.L-1 (0 °C e 1 atm de pressão). Por volta dos -110 °C (163 K), condensa-se em um líquido de coloração azul índigo. Seu ponto de congelamento é aos -192,5 °C (80,5 K) e quando sólido, apresenta uma coloração violeta-azulada intensa.
Na forma gasosa, sua solubilidade é de 1,1 g.L-1 em água, na temperatura de 0 °C e 1 atm de pressão. É um composto termicamente instável, sendo considerado explosivo. Uma onda de choque mecânica, uma faísca elétrica, calor ou uma luz intensa podem ser suficientes para iniciar a explosão do ozônio.
Formação do ozônio
Na natureza, o ozônio pode ser formado de duas formas. A principal delas é por meio da ação de radiação solar incidente sobre moléculas de O2:
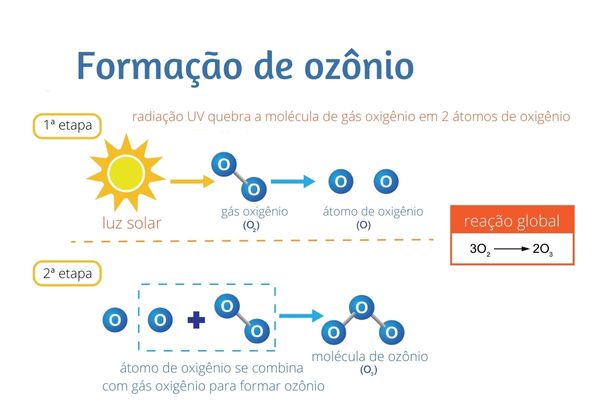
Outro jeito é por meio de descargas elétricas oriundas de tempestades de raios, que também têm energia suficiente para formar o oxigênio atômico por intermédio do O2 e, assim, formar o O3.
Em laboratório, o ozônio pode ser preparado em um aparelho conhecido como ozonizador. Nesse aparelho, uma descarga elétrica entre dois tubos metálicos concêntricos faz O2 gerar átomos de O, formando O3.

Para que serve o ozônio?
O ozônio se destaca por duas características: ser um bom oxidante e ser um bom desinfetante. Por isso, o ozônio é muito utilizado em tratamento de águas e efluentes. Ao oxidar a matéria orgânica e inorgânica presente, o ozônio elimina compostos causadores de sabor, odor, cor, além de diminuir a turbidez, os níveis de ferro, manganês e trihalometanos, substâncias poluentes e cancerígenas.
Como desinfetante, é reconhecido como mais efetivo que o cloro. Uma pequena concentração de 0,01 ppm de O3 já é capaz de ser tóxico para as bactérias. A principal desvantagem na utilização do ozônio, contudo, é sua alta reatividade, fazendo com que essa substância tenha um curto tempo de vida após o tratamento, além de o custo ser mais elevado. Mesmo assim, alguns países mantêm a utilização do ozônio em estações de tratamento.
Na medicina, o ozônio começou a ser empregado no começo do século XX para se explorar seus possíveis efeitos clínicos e farmacológicos benéficos, a chamada ozonioterapia. Inicialmente, aplicou-se a técnica para o tratamento de feridas e infecções cutâneas causadas por bactérias, contudo o efeito positivo na eliminação das bactérias foi suprimido pelos danos causados à pele.
O Conselho Federal de Medicina (CFM) já foi a público dizer que a ozonioterapia não é válida para nenhuma doença. A resolução CFM nº 2.181/2018 afirma que se trata apenas de um procedimento em caráter experimental, não havendo liberação para aplicações clínicas, apenas para o âmbito de estudos científicos. O CFM chegou a afirmar, baseado em estudos recentes e conceituados, que a ozonioterapia para o tratamento de doenças não oferece aos médicos e pacientes a certeza de que é um procedimento eficaz e seguro.
O poder desinfetante do ozônio também foi explorado durante a pandemia de covid-19. Sem qualquer comprovação científica, utilizou-se ozônio em tratamentos e higienização. Era comum, inclusive, a presença de câmaras em formato de túneis para a higienização das pessoas com o ozônio. Tal fato obrigou a Agência Nacional de Vigilância Sanitária (Anvisa) publicar uma nota técnica (nº 38/2020) para afirmar que nenhuma evidência científica existia para justificar a utilização de estruturas de desinfecção no combate ao SARS-CoV-2.
Quem também explora o poder desinfetante do ozônio é a indústria alimentícia, como agente bactericida, melhorando as qualidades sensorial e conservante de espécies marinhas frescas, frutas e vegetais, produtos lácteos e outros. Contudo, a alta reatividade do O3 é também um problema nesse caso. A oxidação de compostos orgânicos e inorgânicos presentes podem gerar substâncias tóxicas e inapropriadas para nosso consumo.
Leia também: Quais são os gases que causam o efeito estufa?
Perigos do ozônio
Sendo um gás, a principal via de contaminação por ozônio é o sistema respiratório. Altamente reativo, ele pode atacar células do trato respiratório e assim causar danos, podendo causar lesões, morte de células pulmonares, hiperplasia, diminuição da atividade pulmonar, inflamação das vias respiratórias, além de tosse, dor no peito, dificuldade em inspirar, dores de cabeça e náuseas. Estuda-se também, como efeitos crônicos, a incidência de asma e câncer.
O ozônio também é fitotóxico (tóxico aos vegetais), atacando principalmente os estômatos (estruturas responsáveis pelas trocas gasosas). Ele pode causar perda de cor das folhas e até mesmo necrose dos tecidos. Sua alta reatividade com ligações duplas também traz problemas em materiais. Essa característica torna a borracha mais quebradiça e também causa o descoramento de tintas. Por isso, o ozônio não pode ter contato com obras de arte, a fim de evitar perdas econômicas.
O maior nível de poluentes atmosféricos, como óxidos de nitrogênio e compostos orgânicos voláteis, acabam por aumentar a concentração de O3 em camadas mais inferiores da atmosfera, como a troposfera. Por ser tóxico em certos níveis, principalmente para idosos, asmáticos e cardíacos, a presença de ozônio ajuda a piorar os índices de qualidade do ar e acarreta problemas de saúde mais graves.
Camada de ozônio
O ozônio tem capacidade de absorver radiação ultraviolenta abaixo de 320 nm, formando, na estratosfera, um escudo protetor de radiações eletromagnéticas de alta energia, prejudiciais para nossa saúde, que poderiam atingir a superfície terrestre.
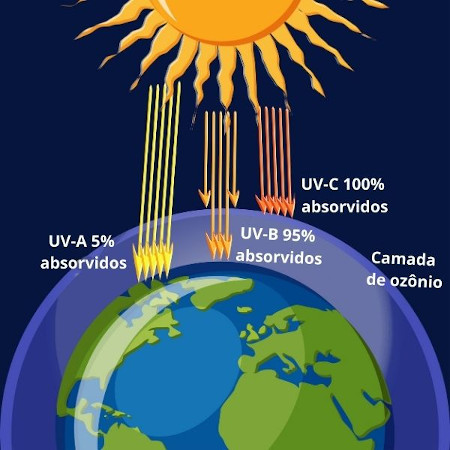
Ao absorver essa radiação, o ozônio é convertido em gás oxigênio. Em condições ideais, um equilíbrio entre as quantidades das duas formas alotrópicas do oxigênio existe, porém a ação antrópica — por conta da utilização de poluentes — afeta esse equilíbrio e acelera a decomposição do ozônio. São exemplos os óxidos de nitrogênio, oriundos de aeronaves, e átomos de cloro produzidos por meio da decomposição fotolítica dos clorofluorcarbonetos (CFCs) de aerossóis e fluidos refrigerantes.
As reações de decomposição do ozônio são mostradas a seguir:
NO2 + O3 → NO3 + O2
NO3 → NO + O2
NO + O3 → NO2 + O2
Cl + O3 → ClO + O2
ClO + O → Cl + O2
-
Videoaula sobre a camada de ozônio
Por Stéfano Araújo Novais
Professor de Química

