A solubilidade é o conceito que apresenta a quantidade de soluto que uma quantidade de solvente é capaz de dissolver, ou seja, a capacidade que um solvente tem de dispersar homogeneamente o soluto. A solubilidade é muito afetada por parâmetros físicos, como a temperatura, além da natureza do soluto e também do solvente.
A solubilidade pode ser observada por um parâmetro conhecido como coeficiente de solubilidade, que apresenta a quantidade de soluto que uma quantidade padrão de solvente é capaz de dissolver em uma dada temperatura. Com os dados de coeficiente de solubilidade para diversas temperaturas, podemos montar a curva de solubilidade.
Leia também: Diferença entre soluto e solvente
Tópicos deste artigo
- 1 - Resumo sobre solubilidade
- 2 - Videoaula sobre solubilidade
- 3 - Afinal, o que é solubilidade?
- 4 - Coeficiente de solubilidade
- 5 - Fórmula do coeficiente de solubilidade
- 6 - Curva de solubilidade
- 7 - Fatores que afetam a solubilidade
- 8 - Produto de solubilidade
- 9 - Exercícios resolvidos sobre solubilidade
Resumo sobre solubilidade
- A solubilidade apresenta a proporção em que determinado soluto pode estar presente em um determinado solvente.
- É influenciada por propriedades físicas do sistema, como a temperatura, bem como aspectos ligados à natureza do soluto e do solvente.
- O coeficiente de solubilidade apresenta a máxima quantidade de soluto que uma quantidade de solvente pode dissolver em uma temperatura específica.
- A junção dos diversos coeficientes de solubilidade faz gerar a curva de solubilidade.
- Para solutos muito pouco solúveis, pode-se estudar o equilíbrio químico relacionado à solubilidade, conhecido como produto da solubilidade.
Videoaula sobre solubilidade
Afinal, o que é solubilidade?
A solubilidade é a capacidade que um soluto tem de se dispersar homogeneamente em um solvente.
A solubilidade pode ser maior ou menor, a depender da natureza do soluto, do solvente e de parâmetros físicos, como temperatura e pressão. Quando um soluto não é capaz de ser dispersado homogeneamente por um determinado solvente, dizemos que ele é insolúvel.
Coeficiente de solubilidade
O coeficiente de solubilidade expressa a máxima quantidade de soluto que uma quantidade padrão de solvente é capaz de dissolver em uma dada temperatura. Os dados de coeficiente de solubilidade são experimentais.
|
Coeficiente de solubilidade (g/100 g de água); T = 20 °C |
|
|
BaCl2 |
35,74 |
|
Ca(NO3)2 |
130,95 |
|
CuSO4 |
20,05 |
|
HgBr2 |
0,52 |
|
NaCl |
35,89 |
|
PbI2 |
0,07 |
|
Li2CO3 |
1,35 |
|
KBr |
65,02 |
|
AlF3 |
0,44 |
Quando a proporção de soluto em solvente é igual a estabelecida pelo coeficiente de solubilidade, dizemos que a solução produzida está saturada.
A relação do coeficiente de solubilidade com a temperatura permite classificar a dissolução dos solutos. Quando o coeficiente de solubilidade aumenta com o aumento da temperatura, dizemos que o soluto apresenta dissolução endotérmica. Do contrário, quando o coeficiente de solubilidade diminui com o aumento de temperatura, dizemos que o soluto apresenta dissolução exotérmica.
Leia também: Quais são os tipos de soluções?
Fórmula do coeficiente de solubilidade
Não existe uma fórmula específica para calcular o coeficiente de solubilidade, uma vez que se trata de um dado experimental. Contudo, não existe também um valor universal de quantidade de solvente para um coeficiente de solubilidade, por isso é possível encontrar tabelas com diversas quantidades de solvente, como 100 g ou até mesmo 1000 g. Da mesma forma, alguns autores optam por utilizar dados volumétricos ao invés de dados mássicos, por isso também é comum ver dados em 100 mL ou 1 L (1000 mL) de solvente.
Nesse sentido, é importante, acima de tudo, saber fazer conversões de unidades. Como a maioria das soluções estudadas (para não dizer todas) no ensino médio são aquosas, considera-se a densidade da água igual a 1 g/mL em toda a sua extensão líquida (de 0 °C até 100 °C), o que significa que é indiferente você pensar em 100 g de água ou 100 mL de água.
Por exemplo, se estivermos diante de uma solução de etanol, em que a densidade dele é de, aproximadamente, 0,80 g/mL, devemos entender que 100 mL de etanol correspondem a 80 g deste. Portanto, se um determinado soluto possui, hipoteticamente, solubilidade de 4 g em 100 mL de etanol, isso significa que ele possui uma solubilidade de 4 g em 80 g de etanol. Consequentemente, a solubilidade desse soluto hipotético é de 5 g para cada 100 g de etanol.
Mesmo assim, é possível determinar o coeficiente de solubilidade a partir do percentual mássico de soluto em uma solução saturada deste. Por exemplo, o percentual mássico de soluto (w2) em uma solução é dado por:
\(w_2=\frac{m_2}{m_1+m_2} \)
Em que m1 é a massa de solvente e m2 é a massa de soluto. Portanto, o percentual mássico de solvente (w1) é igual a 1 – w2. Dessa forma, o coeficiente de solubilidade (C.S.) desse soluto, para 100 g de solvente, é dado da seguinte maneira:
\(C.S.=\frac{100\times w_2}{1-w_2}=\frac{100\times w_2}{w_1}\)
A vantagem dessa leitura é que funciona para qualquer solvente, aquoso ou não.
Curva de solubilidade
Outra forma de avaliar a solubilidade de um determinado soluto é por meio da sua curva de solubilidade. A curva reúne os diversos coeficientes de solubilidade em diversas temperaturas de um determinado soluto. Com isso, é possível avaliar se o soluto apresenta uma dissolução que será favorecida com o aumento da temperatura (solutos de dissolução endotérmica) ou com a diminuição da temperatura (solutos de dissolução exotérmica).
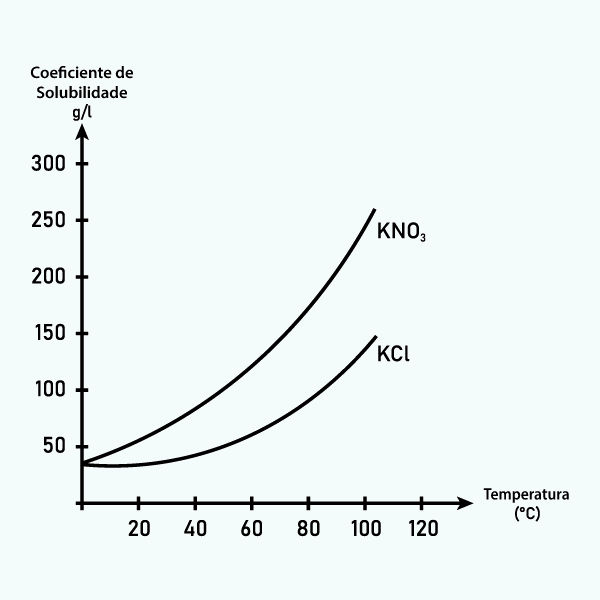
Como os pontos da curva marcam os coeficientes de solubilidade, assim podemos saber o ponto de saturação de soluto em diversas temperaturas. Logo, é possível prever, mais facilmente, como o soluto irá se comportar na solução mediante alterações de temperatura.
Fatores que afetam a solubilidade
Quando falamos de solutos sólidos que virão a ser dissolvidos em solução, o principal fator que afeta a sua solubilidade é a temperatura. Contudo, não há uma forma de prever como a temperatura irá influenciar a variação da solubilidade, ou seja, para saber se a temperatura irá aumentar ou diminuir a solubilidade de um soluto, ou se a variação será mais brusca ou discreta, isso só poderá ser observado mediante experimentos. Porém, no geral, a maioria dos solutos costuma aumentar a sua solubilidade com o aumento da temperatura.
De modo geral, há também uma regra muito interessante para previsão de solubilidade de compostos, que é a regra do semelhante, a qual diz que solventes polares dissolvem substâncias polares, enquanto solventes apolares dissolvem substâncias apolares. Essa regra, no entanto, é mais aplicada para misturas e dissolução de líquidos e de sólidos em líquidos.
Em um ponto de vista mais específico, também é possível avaliar que a natureza do soluto e do solvente irá interferir na dissolução. No caso de sais, que são compostos iônicos, duas coisas devem ocorrer para uma dissolução: a ruptura das interações iônicas e a solvatação dos íons pelo solvente, ou seja, a estabilização deles na solução.
Ocorre que as interações iônicas podem ser suficientemente fortes para que não ocorra a ruptura em solução e, dessa forma, não compensa termodinamicamente a troca da interação iônica por uma atração íon-dipolo com o solvente (no caso dele ser polar) no processo de solvatação.
Um fator ainda interessante é que sais em que cátions e ânions possuem tamanhos opostos, ou seja, um possui raio iônico grande e o outro possui raio iônico pequeno, costumam ser solúveis. Por isso, um sal como fluoreto de prata, AgF, em que se tem um íon de raio grande (Ag+) e um íon de raio pequeno (F−), é solúvel em água, enquanto o LiF, em que ambos os íons possuem um raio pequeno, é muito pouco solúvel em água.
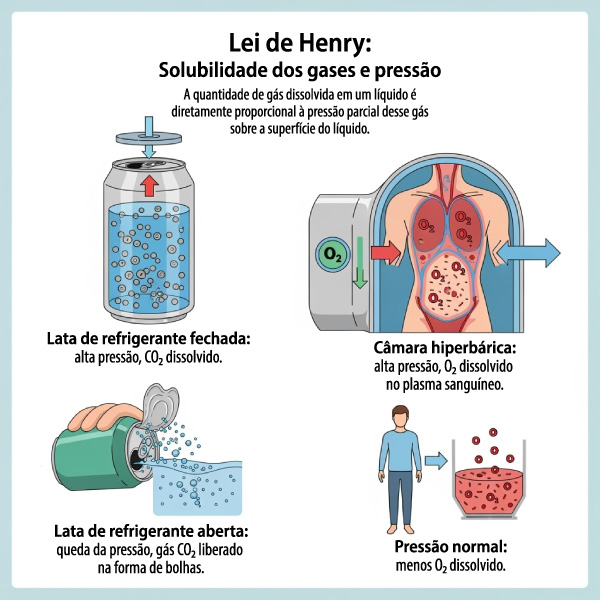
A dissolução de gases, entretanto, possui uma linearidade com alterações de propriedades. Quanto maior a temperatura do solvente, menor a solubilidade do gás. Isso porque o aumento da temperatura ocasiona um aumento da energia cinética das moléculas gasosas, que auxilia no seu desprendimento do solvente líquido.
Ainda em termos de gases, a pressão também pode ser avaliada, uma vez que estamos falando de um estado da matéria que é compressível. A relação entre a pressão e a solubilidade de um gás é determinada pela Lei de Henry, que diz que, quanto maior for a pressão parcial do gás sobre a superfície do líquido, maior será a sua solubilidade.
Produto de solubilidade
De certa forma, não se deve falar que um determinado soluto é “insolúvel”, mas sim que ele é “muito pouco solúvel”, uma vez que, por efeitos diversos, alguma parte do soluto sempre se dissolve, mesmo que mínima.
Em uma solução saturada de um sal muito pouco solúvel, admite-se que o soluto dissolvido estabelece um equilíbrio dinâmico com o seu sólido não dissolvido. Assim sendo, havendo um equilíbrio químico nesse processo, é possível descrever uma constante de equilíbrio, a qual é chamada de produto de solubilidade, Kps.
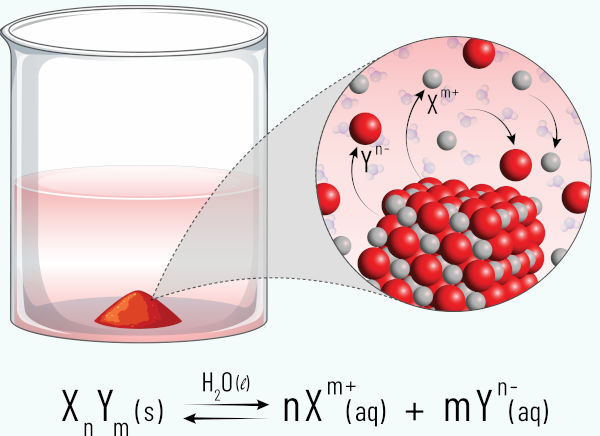
O Kps expressa o produto das solubilidades molares dos íons na solução, que é a concentração molar dos íons na solução, que será representada por “s”. Vejamos no caso do AgI:
AgI (s) ⇌ Ag+ (aq) + I− (aq)
Se a solubilidade molar de AgI, ou seja, a concentração molar de AgI na solução saturada, é igual a s, estequiometricamente, a solubilidade molar dos íons Ag+ e I− também é igual a s.
Assim, a expressão do Kps é:
Kps = [Ag+][I−]
Kps = s ∙ s
Kps = s2
O sal AgI não entra na expressão da constante de equilíbrio, pois sua concentração praticamente não se altera durante o processo de diluição e, além disso, sólidos puros não participam das expressões de constante de equilíbrio (que é o caso do AgI).
Salienta-se que o Kps não é a solubilidade do sal, mas o produto das solubilidades molares. Outro ponto importante é que a expressão do Kps muda a depender do sal. No caso do sulfeto de bismuto, Bi2S3, por exemplo, temos:
Bi2S3 (s) ⇌ 2 Bi3+ (aq) + 3 S2− (aq)
Nesse caso, se a solubilidade molar do sulfeto de bismuto é igual a s, estequiometricamente a solubilidade molar do íon Bi3+ é igual a 2s, enquanto do íon S2− é igual a 3s. Na expressão do Kps, portanto:
Kps = [Bi3+]2[S2−]3
Kps = (2s)2 · (3s)3
Kps = 108s5
Leia também: Como as soluções podem ser classificadas quanto à saturação
Exercícios resolvidos sobre solubilidade
Questão 1
(Unesp 2024.1) Água de cal é o nome dado à solução aquosa saturada de cal hidratada [hidróxido de cálcio, Ca(OH)2]. A concentração dessa solução saturada a 20 ºC é de 1,7 g/L.
A partir desse dado, estima-se que o valor da constante do produto de solubilidade em água (Kps) nessa temperatura é próximo de:
- 8 × 10–6.
- 4 × 10–6.
- 5 × 10–7.
- 8 × 10–4.
- 5 × 10–5.
Resposta: letra E.
A concentração da solução saturada de hidróxido de cálcio é igual a 1,7 g/L. Dessa forma, a sua concentração molar na solução saturada, ou seja, a solubilidade molar, é encontrada pela seguinte conversão:
C = M · MM
Em que C é a concentração em g/L, M é a concentração em mol/L e MM é a massa molar do soluto, nesse caso Ca(OH)2. Substituindo-se os valores, temos que:
1,7 = M · 74
M ≈ 0,023 mol/L
A dissociação do hidróxido de cálcio em água é:
Ca(OH)2 (s) ⇌ Ca2+ (aq) + 2 OH− (aq)
O Kps é:
Kps = [Ca2+][OH−]2
Se a solubildiade molar do Ca(OH)2 é igual a s, estequiometricamente do íon Ca2+ será também s, enquanto o íon OH− será o dobro, 2s. O Kps é reduzido, portanto, a:
Kps = s · (2s)2
Kps = 4s3
Porém, a solubilidade molar do hidróxido de cálcio foi calculada como sendo, aproximadamente, 0,023 mol/L. Assim:
Kps = 4 · (0,023)3
Kps = 4,87 x 10−5 ≈ 5 x 10−5
Questão 2
(Facisa 2022.2) Observe as curvas de solubilidade do gráfico e as assertivas apresentadas abaixo:
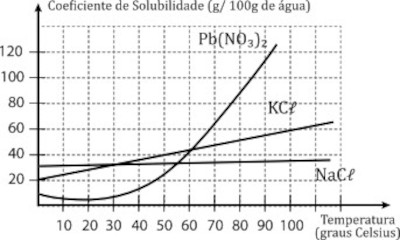
- A solubilidade do Nitrato de Chumbo e a do Cloreto de Potássio aumentam com o aumento da temperatura e a do Cloreto de Sódio diminui com o aumento da temperatura.
- IA solubilidade do Nitrato de Chumbo é mínima a 20 °C.
- Conseguimos dissolver cerca de 60 g de Cloreto de Potássio na temperatura de 100 °C.
- A 90 °C a maior quantidade de sal que podemos dissolver em 100 g de água é a de NaCl.
Estão corretas:
- apenas II e IV.
- todas.
- apenas I, II e III.
- apenas II e III.
- apenas I e III.
Resposta: Letra D.
Afirmativa I está errada, pois a temperatura do cloreto de sódio, NaCl, também aumenta (mesmo que discretamente) com o aumento da temperatura.
Afirmativa IV está errada, pois o sal mais solúvel a 90 °C é o nitrato de chumbo, Pb(NO3)2.
Fontes:
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
ATKINS, P.; JONES, L.; LAVERMAN, L. Princípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
FRANCISCO, F. M.; DO CANTO, E. L. Química na abordagem do cotidiano. 5ª ed. vol. 1. São Paulo: Moderna, 2009.
USBERCO, J.; SPITALERI, P.; SALVADOR, E. Química 1: conecte live. 3ª ed. vol. 1. São Paulo: Saraiva, 2018.
REIS, M. Química: ensino médio. 2ª ed. vol. 1. São Paulo: Ática, 2016.
HAYNES, W. M. (ed.) CRC Handbook of Chemistry and Physics. 95a ed. CRC Press: 2014.


