Alguns compostos possuem em sua estrutura ligações duplas alternadas com ligações simples. O mais famoso de todos eles é o benzeno, cuja estrutura foi proposta em 1865, pelo químico alemão Friedrich August Kekulé (1829-1896). Sua estrutura seria cíclica e formada por três ligações duplas intercaladas com três ligações simples, conforme as figuras abaixo:
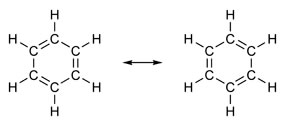
As duas formas de representar o benzeno são aceitas, pois é possível mudar os elétrons das ligações π sem mudar a posição dos átomos. Entretanto, nenhuma representa exatamente o que ele é e nem explica seu comportamento. Ele deveria se comportar como um alceno e provocar reações de adição, porém, na prática, isto não ocorre. O benzeno é bastante estável e age como se não tivesse as ligações duplas; ele dá reações de substituição como nos alcanos.
Em 1930, o cientista americano Linus Pauling propôs a teoria da ressonância que explicou esta aparente contradição. Esta teoria dizia o seguinte:
“Sempre que, em uma fórmula estrutural, pudermos mudar a posição dos elétrons sem mudar a posição dos átomos, a estrutura real não será nenhuma das estruturas obtidas, mas sim um híbrido de ressonância daquelas estruturas.”
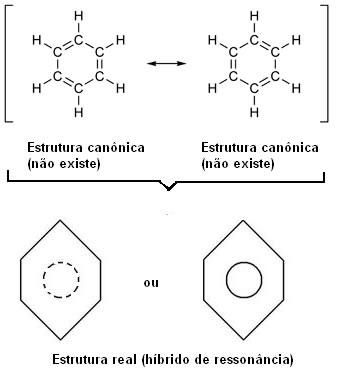
Este efeito é comprovado pelo tamanho das ligações dos carbonos, e pela distância entre eles. Essa distância é intermediária a da ligação simples (1,54 Å) e a da ligação dupla (1,34 Å); sendo, portanto, de 1,39 Å, em virtude do efeito de ressonância.
Este efeito também pode ser visto na estrutura da molécula de ozônio (O3), conforme mostrado abaixo:
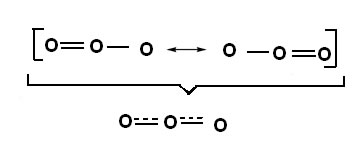
Estruturas canônicas e híbrido de ressonância do ozônio.
Por Jennifer Fogaça
Graduada em Química
Equipe Brasil Escola.
