O ouro é um metal de coloração dourada, de aspecto brilhante, resistente à corrosão, dúctil e maleável. Sua beleza fez desse metal um dos mais cobiçados ao longo da história da humanidade, seja por importância econômica, seja por questões religiosas e esotéricas. É considerado o mais nobre dos metais, embora não seja o mais caro nas cotações atuais.
O ouro é um metal imutável, uma vez que sua inércia química permite que sua aparência permaneça inalterada por milênios, como é o caso do ouro presente na máscara do faraó Tutancâmon, a qual se mantém como se tivesse sido confeccionada pouco tempo atrás. O ouro está amplamente disperso no mundo todo e, por isso, foi descoberto por vários grupos distintos em muitos locais e épocas diferentes, estando atrelado à cultura e história de diversas sociedades. Infelizmente, muitos lutaram e morreram por ele.
Confira no nosso podcast: Duro como diamante — o que significa?
Tópicos deste artigo
- 1 - Resumo sobre ouro
- 2 - Propriedades do ouro
- 3 - Características do ouro
- 4 - Onde é encontrado o ouro?
- 5 - Obtenção do ouro
- 6 - Pureza e quilates do ouro
- 7 - Aplicações do ouro
- 8 - História do ouro
- 9 - Exercícios resolvidos sobre ouro
Resumo sobre ouro
-
O ouro é um metal de coloração amarela, com brilho característico.
-
Tem elevada densidade e baixa reatividade química.
-
Pode ser encontrado em diversos locais do planeta, majoritariamente na forma pura.
-
Atualmente, é obtido por meio do processo de cianetação e, após isso, via precipitação com zinco ou adsorção com carvão ativado.
Não pare agora... Tem mais depois da publicidade ;) -
A pureza do ouro é expressa por meio da unidade quilate (k).
-
O ouro é utilizado na fabricação de joias, moedas, catalisadores, dispositivos eletrônicos, pigmento, película refletora de radiação infravermelha, entre outros usos.
-
Os utensílios mais antigos feitos de ouro datam de 4600–4200 a.C. Esse metal talvez tenha sido o primeiro a ser manipulado pela humanidade, junto do cobre.
Propriedades do ouro
-
Símbolo: Au.
-
Número atômico: 79.
-
Massa atômica: 196,97 u.m.a.
Não pare agora... Tem mais depois da publicidade ;) -
Ponto de fusão: 1064 °C.
-
Ponto de ebulição: 2856 °C.
-
Densidade: 19,32 g/cm³ (20 °C).
-
Isótopos naturais: 197Au (100%).
-
Estados de oxidação: +1, +3.
-
Configuração eletrônica: 4f14 5d10 6s1.
Não pare agora... Tem mais depois da publicidade ;)
Características do ouro

O ouro é um metal conhecido por sua inércia química, ou seja, sua pequena reatividade: não é atacado por O2 e nem por ácidos não oxidantes. O ouro dificilmente é dissolvido, sendo necessárias condições extremamente oxidantes e temperatura intensa, como, por exemplo, uma mistura de ácido clorídrico e ácido nítrico altamente concentrados, conhecida como aqua regia. O ouro também é capaz de reagir com halogênios e ser dissolvido por BrF3 líquido.
Entre os metais, o ouro é considerado o mais maleável e dúctil, podendo um grama ser laminado em uma extensão de, aproximadamente, um metro quadrado. Outro destaque é sua alta condutividade elétrica, sendo o terceiro metal com maior condutividade da Tabela Periódica, ficando atrás apenas de outros dois metais de seu grupo: a prata, a maior condutora de todos eles, e o cobre, o segundo maior condutor de eletricidade.
Apresenta elevada densidade, além de possuir uma coloração amarela e brilho característicos. Em altas temperaturas, emite vapores violetas até atingir seu ponto de ebulição.
-
Videoaula sobre Tabela Periódica
Onde é encontrado o ouro?
Uma avaliação do Serviço Geológico dos Estados Unidos estima que existam cerca de 53 mil toneladas de ouro em reservas minerais, ou seja, a quantidade economicamente viável para extração. Os recursos minerais naturais de fato são muito maiores, mas ainda de difícil extração.
As principais reservas minerais mundiais estão nos seguintes países:
-
Austrália (cerca de 10 mil toneladas);
Não pare agora... Tem mais depois da publicidade ;) -
Rússia (cerca de 7,5 mil toneladas);
-
Estados Unidos (cerca de 3 mil toneladas);
-
África do Sul e Peru (cerca de 2,7 mil toneladas cada);
-
Indonésia (cerca de 2,6 mil toneladas);
-
Brasil (cerca de 2,4 mil toneladas).

No Brasil, a maior parte do ouro produzido provém de minas localizadas nos estados de Minas Gerais, Goiás, Bahia e Amapá. O ouro é um dos poucos metais que podem ser encontrados na natureza em sua forma nativa (lembre-se que é quimicamente inerte), com um teor médio de 85–95% em ouro e o resto em prata. Contudo, também pode ocorrer em outros 19 minerais, embora a maioria seja rara ou raríssima. É o caso dos teluretos, sendo a calaverita, AuTe2, e a silvanita, (Ag,Au)Te2, os mais frequentes.
Leia também: Telúrio — o semimetal que reage quimicamente com a maioria dos elementos químicos existentes
Obtenção do ouro
Inicialmente, as técnicas de extração do ouro eram constituídas pela separação gravítica (ou gravimétrica) e técnicas complementares, como a cominuição (quebra em partículas menores) e a amalgamação. Isso se baseava em algumas características do ouro, tais como:
-
Elevada densidade, o que facilitava na separação gravítica;
-
Hidrofobicidade natural;
-
Capacidade de ser incorporado ao mercúrio, formando uma amálgama.
Contudo, tais técnicas só serviam para amostras de ouro de fácil lavra e extração, não sendo adequadas para a extração de ouro fino (puro) e ouro associado a sulfetos, por exemplo. Com isso, desenvolveu-se a técnica hidrometalúrgica de cianetação, em 1887, pelo químico escocês John S. MacArthur e pelos irmãos e médicos, também escoceses, Robert e William Forrest. Nessa técnica, após o ouro ser moído e concentrado, ele pode ser dissolvido (lixiviado) em uma solução de íons cianeto em meio básico, conforme mostra a reação a seguir:
4 Au + 8 CN- + 2 H2O + O2 → 4 Au(CN)2- + 4OH-
O processo deve ocorrer em meio básico, a fim de se evitar a hidrólise do íon cianeto, a qual forma o ácido cianídrico, HCN, conforme mostra a reação a seguir.
CN- + H2O ⇌ HCN + OH-
A formação de HCN, de alta pressão de vapor (muito volátil), traz implicações econômicas (perda de reagente) e ambientais (elevada toxicidade). O ouro pode, então, ser coletado via precipitação com zinco ou por adsorção com carvão ativado.
Pureza e quilates do ouro
O ouro pode ser classificado como fino, quando é puro, ou baixo, quando a liga metálica apresenta pouco teor de ouro. Esse teor em uma liga metálica é tradicionalmente expresso em quilates (k), que indica a quantidade de partes de ouro em um total de 24 partes de metal. Cada quilate representa cerca de 4,16% em ouro. Por exemplo, quando falamos em uma joia de 18k, queremos dizer que ela possui 18/24 em partes de ouro, ou seja, 75% em ouro.
Essa gradação existe porque o ouro é demasiadamente mole para ser utilizado em sua forma pura (24k), sendo necessária sua comercialização em ligas. A tabela a seguir relaciona a pureza e o quilate de ouro.
|
Quilate |
Teor de ouro (em %) |
|
24 |
99,99 |
|
22 |
91,67 |
|
18 |
75,00 |
|
14 |
58,30 |
|
10 |
41,67 |
|
8 |
33,33 |
Aplicações do ouro
Quando se fala em ouro, logo vem à tona a sua utilização em artigos preciosos, como joias. De fato, o ouro há muito tem sido utilizado para essa finalidade. Os egípcios, por exemplo, já utilizavam a beleza do ouro para a criação de artefatos e ornamentos, que foram associados à ideia de riqueza e eternidade.

O ouro também foi utilizado como padrão monetário, na confecção de moedas e também com finalidades religiosas e esotéricas. Os egípcios utilizavam nanopartículas de ouro em suspensão para o fabrico de seu “elixir da longa vida”, uma bebida que seria capaz de estimular a mente e restaurar a juventude. Os maias, astecas e incas consideravam o ouro como um objetivo divino, uma dádiva.
Em aplicações contemporâneas, o ouro tem sido utilizado em microscopia eletrônica e como agente colorante, caso do “púrpura de Cassius”, um pigmento roxo formado pela reação de sais de Au3+ com cloreto de estanho II, usado na fabricação de vidro rubi. Sua boa condutividade elétrica e excelente resistência à corrosão também o coloca como um importante elemento na indústria de eletroeletrônicos e em processos eletroquímicos.

O ouro também tem boa utilização como catalisador, pois para isso são necessárias pequenas quantidades desse metal, além de ser muito seletivo. Utiliza-se ouro como catalisador para oxidação de monóxido de carbono, hidrocloração do acetileno (para produção de PVC), oxidação alcoólica, epoxidação de alcenos e diversas outras reações, tornando-as mais rápidas e eficientes, o que auxilia o meio ambiente.
Já na indústria farmacêutica, remédios à base de ouro, como a auranofina (C20H35AuO9PS), têm sido utilizados no tratamento de artrite reumatoide. Outros compostos de ouro também apresentam características antitumorais, como o iminofosforano organoaurífico III. Ainda no tratamento do câncer, o radioisótopo sintético 198Au, na forma de coloide, pode ser usado na erradicação de tumores sólidos.

Além disso, por ser um bom refletor de radiações infravermelhas, o ouro é aplicado em películas da cobertura protetora de satélites e nos visores de trajes espaciais, com a finalidade de reduzir o aquecimento interno proveniente da radiação solar. Quando essas películas são aplicadas em janelas, pode-se reduzir a necessidade da utilização do ar-condicionado, além de conferirem maior beleza à fachada.
Veja também: Energia solar — a alternativa renovável que é promissora em relação à produção energética do futuro
História do ouro
O nome ouro deriva do latim aurum, que significa aurora reluzente. É difícil dizer quais foram os primeiros povos a manipularem o ouro, mas sabe-se que os objetos mais antigos são datados de 4600–4200 a.C., os quais foram encontrados em sepulcros localizados na cidade de Varna, Bulgária.
Daí para frente, civilizações antigas, como egípcios e povos americanos pré-colombianos, também fizeram uso intenso do ouro.

Tal utilização pode ter sido incentivada pelo fato de que o ouro pode ser encontrado puro na natureza, o que facilitou sua manipulação e utilização. Sabe-se que o ouro está bem disperso pelo planeta, o que propiciou que fosse descoberto e utilizado por diversas sociedades de épocas e locais diferentes. É provável que o ouro tenha sido, junto do cobre, um dos primeiros metais a serem utilizados.
O Brasil já foi o maior produtor de ouro do mundo. Isso ocorreu durante o ciclo do ouro, entre 1700 e 1850, com uma produção estimada de 16 toneladas anuais. Contudo, na década de 1980, a exploração aurífera brasileira deu um salto, com a descoberta do garimpo de Serra Pelada, fazendo a produção brasileira quintuplicar de 20 toneladas para 100 toneladas anuais, em média.
Exercícios resolvidos sobre ouro
Questão 1
Um jovem casal decidiu se casar. Seguindo o costume, os dois indivíduos foram a uma joalheria escolher suas alianças. O casal ficou interessado em uma aliança de ouro cuja etiqueta apontava 15 quilates. Sabendo que essa aliança possui uma massa total de 4,0 gramas, qual é sua massa de ouro puro?
A) 4,0 g.
B) 2,0 g.
C) 2,5 g.
D) 3,0 g.
E) 24,0 g.
Resolução:
Alternativa C
A aliança de 15 quilates e massa de 4 g apresenta 15/24 gramas de ouro, o que quer dizer que possui 2,5 gramas do metal, como mostra o cálculo a seguir:
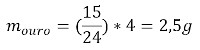
Questão 2
(Udesc 2013) O ouro puro possui algumas características químicas: cor amarelada e brilhante, alta densidade e significativa inércia química, ou seja, baixa reatividade. É extremamente maleável e dúctil, pois, com apenas 1,0 grama deste elemento, é possível confeccionar um fio de até 3,0 km de comprimento com 0,005 mm de espessura. Em relação a este elemento químico, assinale a alternativa correta.
A) O ouro não pode ser considerado um metal de transição externa.
B) Quando este elemento se apresenta na forma catiônica trivalente, estão presentes 76 elétrons em sua eletrosfera.
C) No ouro o subnível energético 4d está incompleto, possuindo 9 elétrons.
D) Este elemento químico pertence a um período incompleto da tabela periódica.
E) Neste elemento químico a espécie Au1+ possui 80 prótons no núcleo.
Resolução:
Alternativa B
O ouro possui número atômico 79. Isso quer dizer que em sua forma atômica, ou seja, fundamental, possui 79 prótons e, também, 79 elétrons. Ao se transformar em um cátion trivalente, ou seja, de carga +3, o ouro perde três dos 79 elétrons que possui, restando-lhe 76.
A alternativa A está incorreta, pois o ouro é um metal de transição de externa.
A alternativa C está incorreta, pois pela distribuição eletrônica do ouro, o subnível 4d está completo.
A alternativa D está incorreta, pois o período do ouro na Tabela Periódica possui todos os elementos, estando, então, completo.
A alternativa E está incorreta, pois a espécie Au1+ não ocorre por receber um próton, mas por perder um único elétron. Ao se tornar um íon, uma espécie não ganha ou perde prótons.
Créditos da imagem:
Andreas Wolochow / Shutterstock.com
Por Stéfano Araújo Novais
Professor de Química

