A camada de ozônio, como o próprio nome diz, é uma camada ou revestimento formado por moléculas do gás ozônio (O3(g)), uma forma alotrópica do oxigênio cuja molécula é mostrada abaixo:
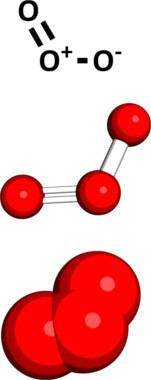
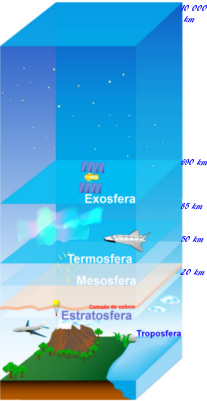
Ela situa-se em uma camada externa à atmosfera, em uma altitude entre 20 e 35 km, sendo chamada de estratosfera. Mas esse gás também pode ser encontrado em menor quantidade na troposfera (altitude de cerca de 10 km).
A camada de ozônio possui uma função vital para a manutenção da vida na Terra, pois ela é capaz de absorver até 99% da radiação ultravioleta (UV) proveniente do Sol. Visto que essa radiação tem baixos comprimentos de onda e alta energia, ela possui alto poder de penetração na pele. É essa radiação que provoca o bronzeamento, mas ela também é responsável por muitos efeitos danosos, pois pode danificar o DNA (ácido desoxirribonucleico), provocando mutações genéticas.
A radiação UV divide-se em três faixas de energia distintas: UVA (320 nm a 400 nm), UVB (290nm a 320 nm) e UVC (200 nm a 290 nm). Entre elas, a mais danosa e energética é a UVC, que, felizmente, não atinge a superfície terrestre porque é filtrada pela camada de ozônio.
Assim, a camada de ozônio é realmente um escudo versátil e eficiente que ajuda a proteger dessa radiação nociva muitas formas de vida, como os plânctons, que são os responsáveis pela produção de grande parte do nosso oxigênio.
A quantidade de ozônio na estratosfera não é constante, mas ela é diretamente proporcional à intensidade da radiação UV. A formação das moléculas desse gás ocorre por meio da decomposição das moléculas do gás oxigênio (O2(g)), formando oxigênio livre que reage, em uma segunda etapa, com o gás oxigênio:
1ª etapa: O2(g) → 2 O(g)
2ª etapa: O(g) + O2(g) → 1 O3(g)
Forma-se, então, um equilíbrio químico na camada de ozônio:
2 O2(g) ↔ 1 O3(g) + O(g) ∆H = + 142,35 kJ/mol
Infelizmente, porém, o ser humano lançou ao longo do tempo alguns compostos poluentes que deslocaram esse equilíbrio no sentido de decomposição do ozônio, diminuindo a sua concentração na estratosfera e deixando o planeta mais desprotegido.
Um dos maiores causadores da destruição da camada de ozônio são os CFCs (Clorofluorcarbonetos, também conhecidos como Fréons®), que são compostos formados por átomos de carbono, flúor e cloro. Os CFCs são lançados na atmosfera principalmente pelo seu uso como propelente de aerossóis (sprays), em geladeiras e refrigeradores, como agente expansor de plásticos e em solventes para limpar circuitos eletrônicos.

Como se pode ver nas reações abaixo, quando o CFC atinge a estratosfera, a radiação solar decompõe suas moléculas, liberando cloro. O cloro, por sua vez, reage com o ozônio e isso diminui a sua concentração:
CH3Cℓ(g) → CH3(g) + Cℓ(g)
Cℓ(g) + O3(g) → CℓO(g) + O2(g)
Além disso, o CℓO formado também reage com os átomos de oxigênio livres na atmosfera, liberando mais átomos de cloro, que irão reagir com o ozônio, destruindo cada vez mais nossa camada protetora:
ClO(g) + O(g) → Cl(g) + O2(g)
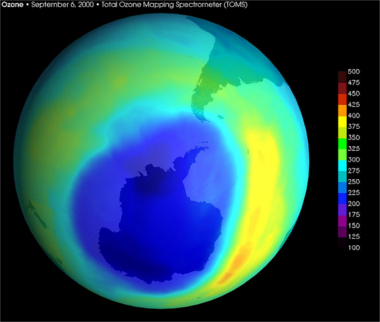
O lugar mais afetado é a Antártida, onde o buraco na camada de ozônio era duas vezes maior que na Europa em setembro de 2000. O satélite de monitoração da camada de ozônio da Nasa registrou o maior buraco já observado sobre a Antártida, medindo cerca de 28,3 milhões de quilômetros quadrados, o que representa mais de três vezes a área da Austrália. Essa situação é pior na Antártida porque lá a formação de átomos de cloro é muito grande e mantém-se inalterada, em razão das atípicas nuvens estratosféricas formadas durante o inverno austral, sendo na superfície das partículas dessas nuvens que ocorrem as reações mostradas.
As possíveis consequências da destruição da camada de ozônio são o aumento da incidência do câncer de pele, em virtude da ação dos raios ultravioletas, e a intensificação do aquecimento global, o que leva a vários resultados catastróficos, como o descongelamento de geleiras polares, aumentando o nível das águas nos oceanos.
Mas ainda resta uma ponta de esperança, pois desde 2000 as concentrações de CFCs têm diminuído quase um por cento ao ano.
Por Jennifer Fogaça
Graduada em Química

