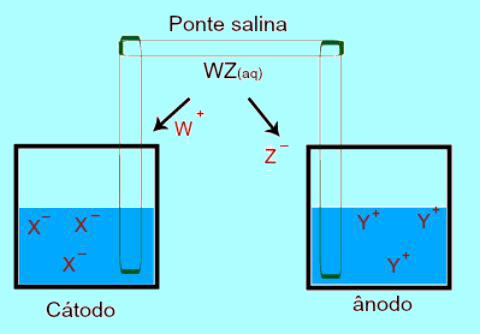
A ponte salina foi proposta pelo químico inglês Frederic Daniell, em 1836, quando esse estudioso montou a pilha que recebeu o seu nome (Pilha de Daniell). Essa ponte é um tubo em forma de U que apresenta duas extremidades porosas (constituídas por algodão ou ágar-ágar) e contém uma solução aquosa formada por água e um sal. Ela conecta de forma indireta as soluções das duas semicelas da pilha (o ânodo e o cátodo).
Observação: O ânodo é o polo negativo da pilha e é onde ocorre a oxidação, e o cátodo é polo positivo e onde ocorre a redução.
Para compreendermos a importância da ponte salina, inicialmente é necessário compreendermos o funcionamento da pilha. Veja o esquema a seguir:
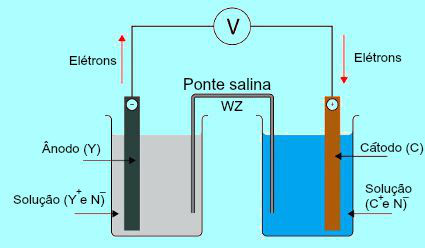
Esquema geral de uma pilha de Daniell
-
Inicialmente, o metal (Y) da placa presente no ânodo sofre oxidação. Ao sofrer oxidação, o metal transforma-se em cátion, que cai na solução em que a placa está. Por essa razão, a solução do ânodo passa a apresentar uma maior concentração de cátions (Y+). Nesse caso, é observada uma diminuição da placa de metal do ânodo.
Y → e- + Y+
-
Em seguida, os elétrons perdidos durante a oxidação do metal da placa do ânodo percorrem o fio elétrico externo e dirigem-se até a placa de metal presente no cátodo. Assim, a placa presente no cátodo fica carregada de elétrons.
-
Os cátions presentes (C+) na solução deslocam-se em direção à placa do cátodo porque ela está carregada com elétrons. Os cátions, ao ganharem os elétrons presentes na placa, tornam-se neutros (estáveis e sólidos) e aderem-se a ela. Por essa razão, a solução do cátodo passa a apresentar uma maior concentração de ânions do que de cátions. Nesse caso, é um observado um aumento de tamanho da placa de metal do cátodo.
C+ + e- → C
A partir da compreensão do funcionamento da pilha de Daniell, é possível observar que a solução presente no ânodo recebe uma maior quantidade de cátions Y+ em virtude da oxidação do metal da placa X. Já a solução presente no cátodo perde seus cátions (C+) porque eles sofrem redução na placa.
É exatamente nessa questão em que o trabalho da ponte salina é evidenciado. A principal função dessa ponte é promover o equilíbrio de cargas presentes tanto nas soluções do ânodo quanto do cátodo. Na ponte salina, temos sempre um sal (geralmente o cloreto de potássio ou nitrato de amônio.) dissociado em água. Veja a representação de uma equação na ponte salina:
WZ + H2O → W+ + Z-
Na ponte salina, há dois íons (W+ e Z-), que são deslocados para o cátodo e para o ânodo de acordo com:
a) O ânodo recebe os ânions (Z-) presentes na ponte salina em virtude da oxidação do elemento (Y), que causa o aumento da quantidade de cátions (Y+) na solução.
b) O cátodo recebe cátions (W+) da ponte salina porque, durante o funcionamento da pilha, o cátion (C+) presente na solução é reduzido na placa. Assim, a solução do cátodo passa a ter uma maior quantidade de ânions (N-) e, por isso, recebe o cátion presente na ponte salina.
Por Me. Diogo Lopes Dias