Ponte salina é uma ligação que existe entre o eletrodo positivo e o eletrodo negativo de uma pilha. Ela pode ser constituída de um tubo de vidro em formato de U, preenchido com uma solução aquosa concentrada de um sal bastante solúvel; pode ser o cloreto de potássio (KCl(aq)), o nitrato de amônio (NH4NO3(aq)), o nitrato de sódio (NaNO3(aq)) ou o nitrato de potássio (KNO3(aq)).
Nas extremidades desse tubo coloca-se com um algodão, lã de vidro ou ágar-ágar (substância gelatinosa retirada de algas vermelhas que é usada em alimentos e como meio de cultura em laboratórios bacteriológicos).

Ágar-ágar, substância retirada de algas vermelhas (imagem no centro), que serve para produzir alimentos, meio de cultura e é usada na ponte salina.
Para entendermos a necessidade da implantação de uma ponte salina entre os eletrodos de uma pilha, observe a imagem abaixo e relembre alguns conceitos de pilha.
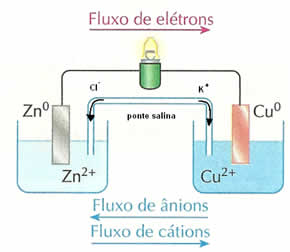
Numa pilha há o ânodo ou polo negativo de onde migram os elétrons em direção ao cátodo, ou polo positivo. No caso apresentado, o ânodo é o zinco metálico (da placa - Zn0) e o cátodo, os cátions de cobre (Cu2+). Com o passar do tempo, essa transferência de elétrons fará com que ambas as soluções percam sua neutralidade elétrica, porque haverá excesso de íons, tornando as soluções instáveis e interrompendo precocemente o funcionamento da pilha.
Assim, para eliminar esses excessos, usa-se a ponte salina ou uma placa de porcelana porosa, que permite a migração dos íons de uma solução para a outra. Desse modo, os íons permanecem em equilíbrio e a pilha continua funcionando.
Na ponte salina da pilha citada acima, temos a migração de íons cloreto (Cl1-(aq)) para o eletrodo de zinco por causa do surgimento de íon zinco (Zn2+(aq)); e os íons de potássio (K1+(aq)) são transferidos para o eletrodo de cobre, que é menos reativo que o zinco, para neutralizar o excesso de cargas negativas (SO42-(aq)) que ocorre devido à diminuição de íons Cu2+(aq) em solução.
Por Jennifer Fogaça
Graduada em Química
Equipe Brasil Escola