O cádmio, símbolo Cd e número atômico 48, é um metal pertencente ao grupo 12 da Tabela Periódica. É quimicamente semelhante ao zinco e apresenta, quase sempre, o número de oxidação igual a +2. É geralmente encontrado em minerais de zinco (esfalerita), chumbo (galena) e cobre (calcopirita).
O cádmio e seus compostos são tóxicos, e ele é considerado um metal pesado. Por isso, pessoas que manipulam esse elemento devem ter cuidado para não desenvolver doenças ou problemas graves de saúde.
Leia também: Ósmio — o mais pesado dos metais
Tópicos deste artigo
- 1 - Resumo sobre cádmio
- 2 - Propriedades do cádmio
- 3 - Características do cádmio
- 4 - Onde o cádmio pode ser encontrado?
- 5 - Obtenção do cádmio
- 6 - Aplicações do cádmio
- 7 - Relação do cádmio com o meio ambiente
- 8 - Relação do cádmio com a saúde
- 9 - História do cádmio
- 10 - Exercícios resolvidos sobre cádmio
Resumo sobre cádmio
- O cádmio é um metal de transição do grupo 12 da Tabela Periódica.
- Em sua forma metálica, apresenta coloração branco acinzentada ou branco azulada.
- Apresenta grande semelhança química com o zinco, além de ter, quase sempre, o NOx igual a +2.
- É um metal dúctil, maleável e reativo.
- É encontrado associado a outros metais, como zinco, cobre e chumbo; por isso, sua principal forma de obtenção se dá como subproduto da obtenção desses metais.
- É aplicado na produção das baterias níquel-cádmio, na fabricação de pigmentos, em células fotovoltaicas, entre outros.
- É considerado um metal pesado persistente no meio ambiente.
- Sua descoberta se deu no começo do século XIX.
Propriedades do cádmio
- Símbolo: Cd
- Número atômico: 48
- Massa atômica: 122,411 u.m.a
- Eletronegatividade: 1,69
- Ponto de fusão: 321,07 °C
- Ponto de ebulição: 767 °C
- Densidade: 8,642 (a 26 °C)
- Configuração eletrônica: 5s2 4d10
- Série química: grupo 12, metais de transição, metais pesados
Características do cádmio

O cádmio é um metal que, em sua forma metálica, apresenta coloração branca prateada ou branca azulada, além de ser macio (pode ser cortado com uma faca) e dúctil. Quimicamente é muito semelhante ao zinco, elemento logo acima no grupo 12.
Um exemplo dessa semelhança é o fato de ambos formarem uma fina camada de óxido protetiva sobre o metal, protegendo-o de corrosão. Aliás, ambos também possuem baixas taxas de corrosão. O cádmio apresenta oito isótopos naturais, sendo o 114Cd o de maior abundância (28,73%), seguido do 112Cd (24,13%).
Trata-se de um metal reativo, dissolvendo-se lentamente em ácido clorídrico diluído ou ácido sulfúrico, porém dissolve-se rapidamente com ácido nítrico quente diluído. Diferentemente do Zn, o cádmio não apresenta caráter anfótero e não se dissolve em solução alcalina.
Em contato com o ar úmido, o Cd lentamente se oxida e, quando aquecido em contato com o ar, forma o óxido de cálcio II (CdO). Ainda aquecido, o cádmio é capaz de reagir com halogênios e enxofre.
O estado de oxidação +2 é o mais importante, praticamente único, uma vez que o estado +1 foi reportado em algumas oportunidades. Apesar da já citada semelhança com o zinco, na forma de óxido, fluoreto, carbonatos e sob condições oxidantes, o cádmio pode se comportar de forma semelhante ao cálcio. Um dos motivos para isso é o fato do raio iônico do Cd2+ (103 pm) ser muito próximo ao do Ca2+ (100 pm).
Saiba mais: Rubídio — outro metal que pode ser cortado com uma faca
Onde o cádmio pode ser encontrado?
A greenockita (CdS) é o mais comum mineral de cádmio. Contudo, raramente ocorre na forma pura, estando mais associada a outros minerais. Por isso, o cádmio é mais comumente encontrado associado a outros minerais, principalmente os de zinco, como é o caso da esfalerita (ZnS), que pode conter até 5% em massa do CdS.

Minerais de chumbo (como a galena, PbS) e cobre (como a calcopirita, CuFeS2) também podem conter cádmio, em uma concentração aproximada de 500 ppm. A monteponita (CdO) e a cadmoselita (CdSe) são outros exemplos de minerais de cádmio. Estima-se que exista de 0,1 ppm a 0,5 ppm de cádmio na crosta terrestre.
Obtenção do cádmio
A principal forma de obtenção de cádmio provém da produção de zinco. Já em menor escala, suas formas de obtenção provêm da reciclagem de produtos que o contenham, como as baterias níquel-cádmio (NiCd), e como subproduto da produção de chumbo e cobre.
No caso principal, o minério de zinco (ZnS) contendo cádmio é processado até se obter um concentrado de Zn. Depois, o sulfeto de zinco/cádmio é convertido a óxido de zinco/cádmio por queima com excesso de oxigênio a uma temperatura abaixo dos 1000 °C, removendo o enxofre na forma de SO2 (posteriormente aproveitado para a produção de ácido sulfúrico).
Posteriormente, durante a extração eletrolítica do zinco, o cádmio precipita. Esse precipitado segue para um tratamento hidrometalúrgico, retirando-se qualquer resquício de zinco e outras impurezas até que o cádmio é obtido com altíssima pureza (da ordem de 99,95% a 99,99%) em uma extração eletrolítica.
Aplicações do cádmio

Boa parte do consumo global de cádmio está na fabricação de baterias níquel-cádmio (NiCd). É bem verdade que elas vêm perdendo espaço para as baterias de níquel-metal hidreto ou de lítio, mas ainda existem aplicações industriais que fazem o uso delas, como em aeronaves comerciais.
Nesse caso, embora novas baterias comecem a aparecer em alguns modelos novos de avião, percebeu-se que as NiCd são menos suscetíveis ao superaquecimento, menos propensas a defeitos internos que podem passar desapercebidos em testes, além de não serem inflamáveis e poderem operar em uma grande faixa de temperatura. E, claro, são mais baratas.
Por isso, ainda se aplica baterias de NiCd no setor ferroviário (sistemas eletrônicos e partida de motor), no setor de telecomunicações em regiões mais quentes, e no armazenamento de energia de células solares ou eólicas, principalmente em áreas remotas, já que necessitam de pouca manutenção.
O cádmio também pode ser utilizado na fabricação de pigmentos, todos inorgânicos e derivados do CdS, o qual apresença uma coloração dourada. Os pigmentos de cádmio podem variar do amarelo brilhante ao marrom.
Por sua boa resistência à corrosão, é aplicado em proteções anticorrosivas utilizadas na indústria militar e aeroespacial. Já o telureto de cádmio (CdTe) é um semicondutor utilizado em filmes fotovoltaicos.
Até meados da década de 90, era comum que o PVC (utilizado em tubos e conexões) utilizasse sais orgânicos de cádmio para sua estabilização, ou seja, impedindo sua degradação quando exposto ao calor, aos raios ultravioletas (Sol) ou a ações do intemperismo. O cádmio ainda possui uma habilidade de capturar nêutrons e, por isso, era utilizado nos primeiros reatores nucleares, em varetas para controlar as reações nucleares.
Veja também: Manganês — um metal muito utilizado na confecção do aço
Relação do cádmio com o meio ambiente
O cádmio e seus compostos são tóxicos. Além do mais, é considerado um metal pesado persistente no meio ambiente. Por conta disso, há preocupação ambiental com seu descarte.
Na natureza, o cádmio pode ocorrer em maior concentração (500 ppm) em alguns tipos de rochas. A erosão e o intemperismo resultam no descarte natural de cerca de 15.000 toneladas de cádmio nos oceanos. A atividade vulcânica também é uma fonte natural de cádmio para a atmosfera, assim como as queimadas em florestas.

Já as emissões antropogênicas são consequência do descarte de produtos que contenham cádmio, como ligas metálicas, baterias NiCd, artefatos pigmentados, entre outros.
Contudo, políticas públicas e maior rigor por parte de alguns países fizeram as emissões antropogênicas de cádmio caírem consideravelmente nos últimos 60 anos. Como consequência, as emissões natural e humana estão se igualando.
Relação do cádmio com a saúde
O cádmio, diferentemente do zinco, não é um elemento considerado essencial para o ser humano, sendo, inclusive, tóxico. Podemos entrar em contato com ele pela alimentação, pela inalação, pelo cigarro ou pela exposição ocupacional.
Uma ingestão de baixos níveis de cádmio por um longo período pode afetar os rins, podendo esse elemento se acumular neles por 20 a 30 anos. Em doses elevadas, o cádmio pode também produzir efeitos adversos no sistema respiratório e nos ossos, tornando-os quebradiços. Ao se ingerir alimentos com altas doses de cádmio, é esperado que se apresente irritação estomacal, provocando vômitos, diarreia e até mesmo a morte.
Trabalhadores que manipulam fertilizantes com fosfato ou são da área de combustíveis fósseis e produção de aço estão expostos à contaminações de cádmio. Já foi reportado, inclusive, casos de câncer de pulmão em estudos com trabalhadores expostos ao cádmio disperso no ar.
Isso levou o Departamento Americano de Saúde e Serviços Humanos (DHHC) a determinar o cádmio e seus compostos como carcinogênicos. A Agência Internacional de Pesquisa em Câncer (Iarc) também determinou o elemento como carcinogênico para seres humanos.
História do cádmio
No começo do século XIX, na região da Prússia, o controle de qualidade de produtos farmacêuticos foi confiado a médicos nomeados pelo governo. Um desses médicos, Johann Roloff, em 1817, suspeitou de um lote de óxido de zinco que seria oriundo da fábrica de Karl Hermann.
Os testes preliminares de Roloff apontaram que as amostras teriam arsênio e, assim, Hermann (preocupado com a reputação de seu negócio) decidiu investigar mais a fundo. Posteriormente, ele e outros conseguiram perceber que o arsênio nada tinha a ver com o problema, mas sim um novo metal até então desconhecido.
Enquanto isso, sendo Inspetor Geral dos boticários no reino vizinho de Hanover e professor na Universidade de Göttingen, Friedrich Stromeyer também estava tentando decifrar um quebra-cabeça com o zinco: amostras de carbonato de zinco, quando aquecidas, deixavam um óxido amarelo. Assim, ele isolou a fonte dessa coloração amarelada, chegando ao óxido de um novo metal.
Os papéis concomitantes de Roloff, Hermann e Stromeyer (que publicizaram suas descobertas) geraram a impossibilidade de se creditar a descoberta do novo metal a uma única pessoa. Posteriormente, mais cientistas publicaram relatos sobre o novo elemento.
Diferentes nomes foram propostos, como klapróvio (em homenagem ao químico e descobridor de elementos Martin Klaproth) e melínio (do latim melinus, fazendo referência à coloração de marmelo).
Contudo, o nome cádmio (proposto por Stromeyer) acabou ficando. O nome deriva de cadmia, termo em latim para calamina e utilizado para diversos minerais à base de zinco.
Exercícios resolvidos sobre cádmio
Questão 1
(Enem)
O cádmio, presente nas baterias, pode chegar ao solo quando esses materiais são descartados de maneira irregular no meio ambiente ou quando são incinerados. Diferentemente da forma metálica, os íons Cd2+ são extremamente perigosos para o organismo, pois eles podem substituir íons Ca2+, ocasionando uma doença degenerativa nos ossos, tornando-os muito porosos e causando dores intensas nas articulações. Podem ainda inibir enzimas ativadas pelo cátion Zn2+, extremamente importantes para o funcionamento dos rins. A figura mostra a variação do raio de alguns metais e seus respectivos cátions.
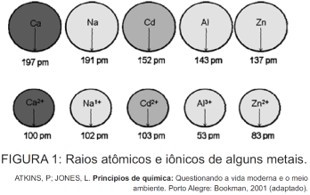
Com base no texto, a toxicidade do cádmio em sua forma iônica é consequência de esse elemento
A) apresentar baixa energia de ionização, o que favorece a formação do íon e facilita sua ligação a outros compostos.
B) possuir tendência de atuar em processos biológicos mediados por cátions metálicos com cargas que variam de +1 a +3.
C) possuir raio e carga relativamente próximos aos de íons metálicos que atuam nos processos biológicos, causando interferência nesses processos.
D) apresentar raio iônico grande, permitindo que ele cause interferência nos processos biológicos em que, normalmente, íons menores participam.
E) apresentar carga +2, o que permite que ele cause interferência nos processos biológicos em que, normalmente, íons com cargas menores participam.
Resolução:
Alternativa C
Quando na forma iônica (+2), o cádmio apresenta carga e raio semelhantes ao íon cálcio. Isso explica o porquê de ele conseguir substituí-lo em processos biológicos, assim ocasionando doenças degenerativas nos ossos. Sua semelhança química com o zinco também permite a interferência no papel biológico desse metal.
Questão 2
(Enem)
Cerca de 1% do lixo urbano é constituído por resíduos sólidos contendo elementos tóxicos. Entre esses elementos, estão metais pesados como o cádmio, o chumbo e o mercúrio, componentes de pilhas e baterias, perigosos à saúde humana e ao meio ambiente. Quando descartadas em lixos comuns, pilhas e baterias vão para aterros sanitários ou lixões a céu aberto, e o vazamento de seus componentes contamina o solo, os rios e o lençol freático, atingindo a flora e a fauna. Por serem bioacumulativos e não biodegradáveis, esses metais chegam de forma acumulada aos seres humanos, por meio da cadeia alimentar. A legislação vigente (Resolução CONAMA no 257/1999) regulamenta o destino de pilhas e baterias após seu esgotamento energético e determina aos fabricantes e/ou importadores a quantidade máxima permitida desses metais em cada tipo de pilha/bateria, porém o problema ainda persiste.
Disponível em: http://www.mma.gov.br. Acesso em: 11 jul. 2009 (adaptado).
Uma medida que poderia contribuir para acabar definitivamente com o problema da poluição ambiental por metais pesados relatado no texto seria
A) deixar de consumir aparelhos elétricos que utilizem pilha ou bateria como fonte de energia.
B) usar apenas pilhas ou baterias recarregáveis e de vida útil longa e evitar ingerir alimentos contaminados, especialmente peixes.
C) devolver pilhas e baterias, após o esgotamento da energia armazenada, à rede de assistência técnica especializada para repasse a fabricantes e/ou importadores.
D) criar nas cidades, especialmente naquelas com mais de 100 mil habitantes, pontos estratégicos de coleta de baterias e pilhas, para posterior repasse a fabricantes e/ou importadores.
E) exigir que fabricantes invistam em pesquisa para a substituição desses metais tóxicos por substâncias menos nocivas ao homem e ao ambiente, e que não sejam bioacumulativas.
Resolução:
Alternativa E
A questão solicita uma medida que possa acabar definitivamente com o problema da poluição ambiental por metais pesados, como o cádmio. A única forma desses elementos saírem dos descartes é se forem extintos das cadeias produtivas. Dessa forma, o gabarito mais adequado é o da letra E, pois, dessa forma, com o passar do tempo, os produtos contendo metais pesados terão sido completamente substituídos, não retornando ao nosso consumo.
Por Stéfano Araújo Novais
Professor de Química

