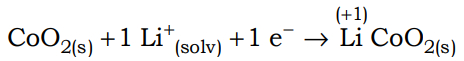As pilhas ou baterias que possuem o lítio como principal constituinte têm como uma de suas características o fato de serem bem leves, pois o lítio é o metal menos denso descoberto até o momento. Para se ter uma ideia, esse metal branco prateado boia na água, pois é duas vezes menos denso que ela. Isso se dá devido ao fato de que o lítio possui apenas três prótons e três nêutrons.
Tópicos deste artigo
Tipos de pilhas e baterias de lítio
Existem dois tipos principais de pilhas ou baterias de lítio, uma delas é denominada de pilha de lítio-iodo. Ela foi desenvolvida principalmente para ser usada em marca-passos cardíacos, já que é bastante leve, segura (não libera gases, pois é fechada hermeticamente), tem uma boa durabilidade (cerca de 8 a 10 anos), fornece uma voltagem de 2,8 V e uma alta densidade de carga (0,8 Wh/cm3).
Os eletrodos são formados por lítio e um complexo de iodo, que ficam separados por meio de uma camada cristalina de iodeto de lítio que permite a passagem da corrente elétrica. O lítio metálico funciona como o ânodo dessa pilha, ou seja, é o polo negativo que se oxida, perdendo elétrons. Já o cátodo, o polo positivo que se reduz, recebendo elétrons, é o complexo de iodo.
Veja as semirreações que ocorrem nos eletrodos e a equação que representa a reação global desse tipo de pilha:
Semirreação do Ânodo: 2 Li(s) →2 Li+(s) + 2e-
Semirreação do Cátodo: 1 I2(s) + 2e-→2 I-(s)
Reação Global: 2 Li(s) + 1 I2(s) →2 LiI(s)
As pilhas de lítio-iodo possuem o formato de moedas bem pequenas, como mostrado na figura abaixo:

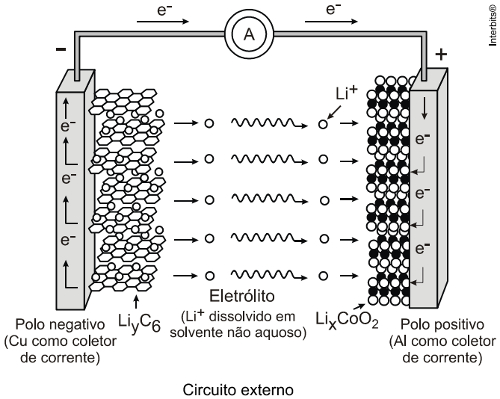
O outro tipo de pilha ou bateria é a de íon lítio. Ela leva esse nome exatamente porque o seu funcionamento se baseia no movimento de íons lítio (Li+). Ela é atualmente muito utilizada nas baterias de telefones celulares e seu potencial varia entre 3,0 e 3,5 V.

O ânodo e o cátodo são formados por átomos dispostos em planos como se fossem lâminas com espaços onde os íons lítio se inserem. O ânodo é formado por grafita com o metal cobre e os íons se intercalam nos planos de estruturas hexagonais de carbono, formando a seguinte substância: LiyC6.Já o cátodo é formado pelos íons lítio intercalados num óxido de estrutura lamelar (LixCoO2).
Assim, temos que os íons lítio saem do ânodo e migram por meio de um solvente não aquoso para o cátodo.
Semirreação do Ânodo: LiyC6 (s) → y Li + C6 + y e-
Semirreação do Cátodo: LixCoO2 (s) + y Li+(s) + y e- → Lix+yCoO2(s)
Reação Global: LiyC6(s) + LixCoO2 → C6 (s) + Lix+yCoO2(s)
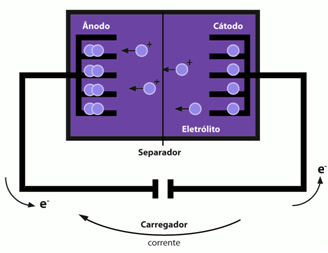
Essas baterias são recarregáveis, bastando usar uma corrente elétrica externa que provoca a migração dos íons lítio no sentido inverso, ou seja, do óxido para a grafita.