As pilhas, ou células eletroquímicas, e as baterias são dispositivos em que a energia química é transformada em energia elétrica de modo espontâneo.A pilha é formada somente por dois eletrodos e um eletrólito, enquanto que a bateria é um conjunto de pilhas em série ou em paralelo.
As pilhas primárias são dispositivos não recarregáveis, sendo que quando a reação de oxirredução que ocorre dentro delas cessa, elas devem ser descartadas.
Para cada equipamento é indicado um tipo de pilha e, entre as pilhas primárias usadas atualmente, temos que as principais são: pilhas secas de Leclanché (pilhas comuns ou pilhas ácidas), pilhas alcalinas e pilhas de lítio/dióxido de manganês.
Veja o que as diferencia e para quais equipamentos elas são indicadas:
- Pilhas Secas de Leclanché:
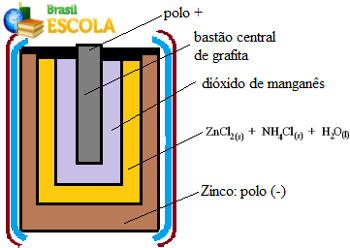
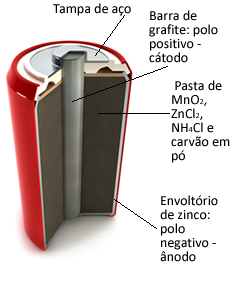
Essas pilhas são formadas basicamente por um envoltório de zinco, separado por um papel poroso e por uma barra central de grafite envolvida por dióxido de manganês (MnO2), carvão em pó (C) e por uma pasta úmida contendo cloreto de amônio (NH4Cl), cloreto de zinco (ZnCl2) e água (H2O).
O zinco funciona como o ânodo, perdendo elétrons; e o grafite funciona como o cátodo, conduzindo os elétrons para o dióxido de manganês:
Semirreação do Ânodo: Zn (s) → Zn2+(aq) + 2 e-
Semirreação do Cátodo: 2 MnO2(aq) + 2 NH4 1+(aq) + 2e- → 1 Mn2O3 (s) + 2NH3(g) + 1 H2O(l)
Reação Global: Zn (s) + 2 MnO2(aq) + 2 NH41+(aq) → Zn2+(aq) + 1 Mn2O3(s) + 2NH3(g)
Esse tipo de pilha é indicado para equipamentos que requerem descargas leves e contínuas, como controle remoto, relógio de parede, rádio portátil e brinquedos.
Você pode obter mais detalhes sobre a origem, funcionamento, durabilidade, ddp, perigos e cuidados que devem ser tomados com essas pilhas no texto “Pilha Seca de Leclanché”.
- Pilhas alcalinas:
Seu funcionamento se assemelha muito com o das pilhas secas de Leclanché, porém, a única diferença está que no lugar do cloreto de amônio (que é um sal ácido), coloca-se uma base forte, principalmente o hidróxido de sódio (NaOH) ou o hidróxido de potássio (KOH).
Semirreação do Ânodo: Zn + 2 OH → ZnO + H2O + 2e-
Semirreação do Cátodo: 2 MnO2 + H2O + 2e-→ Mn2O3 + 2 OH
Reação global: Zn +2 MnO2→ ZnO + Mn 2O3

As pilhas alcalinas são mais vantajosas que as ácidas no sentido de que elas têm uma maior durabilidade, em geral, oferecem de 50 a 100% mais energia que uma pilha comum do mesmo tamanho, além de haver menos perigo de vazamentos.
São indicadas principalmente para aparelhos que exigem descargas rápidas e mais intensas, como rádios, tocadores de CD/DVD e MP3 portáteis, lanternas, câmeras fotográficas digitais etc.
Leia também o texto Pilhas alcalinas.
- Pilhas de lítio/dióxido de manganês:
Essas pilhas são leves e originam uma grande voltagem (cerca de 3,4 V), devido a isso, elas são muito utilizadas em equipamentos pequenos como relógios e calculadoras. Diferentemente dos casos anteriores, o seu formato é de moeda, como mostra a imagem a seguir:

O ânodo é o lítio, o cátodo é o dióxido de manganês e o eletrólito é uma solução salina:
Semirreação do Ânodo: Li →Li+ + e−
Semirreação do Cátodo: MnO2 + Li+ + e− →MnO2(Li)
Reação global: Li + MnO2 → MnO2(Li)
Por Jennifer Fogaça
Graduada em Química