As pilhas comuns são chamadas de pilhas de Leclanché em homenagem ao seu inventor, o químico francês George Leclanché (1839-1882).

George Leclanché (1839-1882)
Leclanché criou esse tipo de pilha no ano de 1866. Ela é chamada também de pilha seca porque até então só existiam pilhas que usavam soluções aquosas, como a Pilha de Daniell.
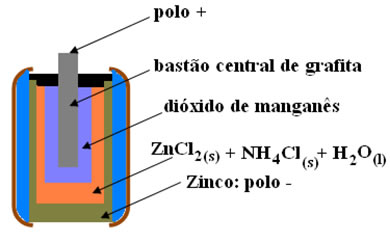
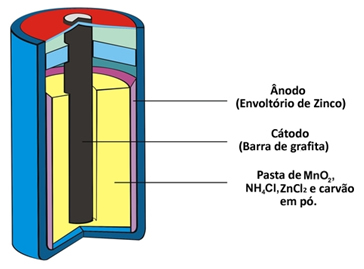
Outras duas denominações que esse tipo de pilha recebe devido a sua constituição é pilha ácida ou pilha de zinco-carbono. Ela é basicamente formada por um envoltório de zinco separado das demais espécies químicas que compõem a pilha por meio de um papel poroso.
Esse zinco corresponde ao polo negativo da pilha ou ânodo, pois ele se oxida, perdendo dois elétrons, segundo a semirreação abaixo:
Polo Negativo – Ânodo: Zn (s) → Zn2+ (aq) + 2 e-
Essa pilha também possui um polo positivo, o cátodo, que é uma barra de grafita instalada no meio da pilha envolvida por dióxido de manganês (MnO2), carvão em pó (C) e por uma pasta úmida contendo cloreto de amônio (NH4Cl), cloreto de zinco (ZnCl2) e água (H2O).
O cloreto de amônio e o cloreto de zinco são sais de caráter ácido, por isso, o nome “pilha ácida”.
A barra de grafita conduz os elétrons perdidos pelo zinco até o manganês, ocorrendo a redução do dióxido de manganês (MnO2) a trióxido de manganês (Mn2O3), segundo a semirreação a seguir:
Polo positivo – Cátodo: 2 MnO2(aq) + 2 NH4 1+ (aq) + 2e- → 1 Mn2O3 (s) + 2NH3(g) + 1 H2O(l)
A pasta úmida faz o papel de ponto salina, permitindo a migração dos ânions hidroxila (OH-) da grafita para o zinco.
A reação global é dada por:
Zn (s) + 2 MnO2(aq) + 2 NH4 1+ (aq) → Zn2+ (aq) + 1 Mn2O3 (s) + 2NH3(g)
Desse modo, essas pilhas não são recarregáveis, uma vez que todo o dióxido de manganês é convertido em trióxido de manganês. Quando a pilha para de funcionar, ela deve ser descartada.
A ddp dessas pilhas é de 1,5V. No entanto, a amônia (NH3(g)) formada no cátodo pode se depositar sobre a barra de grafita, dificultando a passagem dos elétrons e diminuindo a voltagem da pilha. Para voltar ao funcionamento normal, basta deixar a pilha em repouso fora do aparelho, pois o cátion zinco (Zn2+ (aq)) formado no ânodo reage com a amônia, deixando a barra de grafita livre.
Além disso, colocar a pilha na geladeira também pode ajudar, pois a diminuição da temperatura favorece a solubilidade da amônia na pasta úmida da pilha.
Outro fator importante a respeito das pilhas secas de Leclanché que devemos considerar é que o envoltório de zinco pode ser corroído e, com isso, pode vazar o material corrosivo e danificar o aparelho. Assim, o melhor a fazer é não deixar as pilhas dentro de aparelhos que não são continuamente usados.
As pilhas secas são indicadas paraequipamentos que requerem descargas leves e contínuas, como controle remoto, relógio de parede, rádio portátil e brinquedos.
Por Jennifer Fogaça
Graduada em Química