Se utilizarmos um voltímetro em uma pilha, conseguiremos identificar a diferença de potencial (U ou ddp) ou força eletromotriz (fem ou E) entre os dois eletrodos. No entanto, não é possível identificar dessa forma os potenciais de redução ou oxidação de cada eletrodo.
Os cientistas precisavam conhecer esses valores para estudar os processos de oxirredução, assim estabeleceram um estado de referência. Isso significa que se convencionou medir o potencial de cada eletrodo em relação a um outro eletrodo nas seguintes condições-padrão:
• A temperatura deve estar em 25°C;
• A pressão em 1,0 atm;
• A concentração da solução em que o metal está mergulhado deve ser de 1,0 mol/L.
Assim, o eletrodo escolhido foi o eletrodo de hidrogênio, que está representado abaixo:
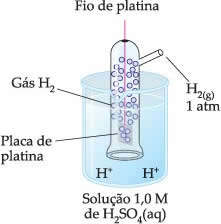
Este eletrodo é composto de um fio de platina ligado a uma placa de platina, que não participa da reação, dentro de um tubo contendo gás hidrogênio e mergulhado em uma solução ácida. No exemplo, a solução foi de ácido sulfúrico.
| Por convenção, foi atribuído ao eletrodo padrão de hidrogênio o valor zero, tanto para o E0red como para o E0oxi. |
Desse modo, para descobrir o valor do potencial de qualquer outro eletrodo é só construir uma pilha do eletrodo que queremos com o eletrodo-padrão de hidrogênio e medirmos a ddp com um voltímetro. O valor apresentado no voltímetro será o próprio potencial do eletrodo procurado, visto que o do hidrogênio é igual a zero.
Por exemplo, interligamos um eletrodo de zinco com o eletrodo de hidrogênio para descobrir qual é seu potencial de redução:
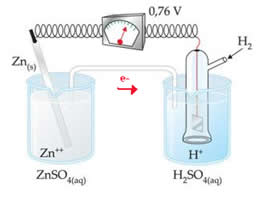
Segundo o esquema acima, o voltímetro identificou a diferença de potencial como sendo igual a +0,76 9(?E0 = +0,76). Observamos também que o eletrodo de zinco oxidou, portanto ele é o ânodo; e o eletrodo de hidrogênio reduziu, sendo o cátodo.
Assim, temos:
?E0 = E0red (cátodo) - E0 red (ânodo)
0,76 = 0,00 - E0 red (Zn)
E0 red (Zn) = 0,00-0,76
E0 red (Zn) = -0,76
O valor negativo significa que a corrente de elétrons flui do eletrodo de zinco (ânodo) para o de hidrogênio, comportando-se, então, como cátodo. Se desse positivo, seria o contrário, e o eletrodo de hidrogênio se comportaria como ânodo. Isso pode ser observado ao interligarmos um eletrodo de cobre com o eletrodo-padrão de hidrogênio:
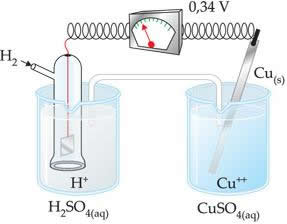
?E0 = E0red (cátodo) - E0 red (ânodo)
-0,34 = 0,00 - E0 red (Zn)
E0 red (Zn) = 0,00+0,34
E0 red (Zn) = +0,34
Desse modo, é possível definir os potenciais de redução e oxidação para as mais variadas espécies químicas. No entanto, a União Internacional da Química Pura e Aplicada (IUPAC) recomenda o uso apenas dos potenciais de redução. E, independentemente do metal utilizado, na representação da pilha, o eletrodo de hidrogênio sempre vem primeiro, por exemplo:
Pt – H2 (g) 1atm / H3O1+ (aq) 1 mol/L // Cu2+ (aq) 1 mol/L / Cu
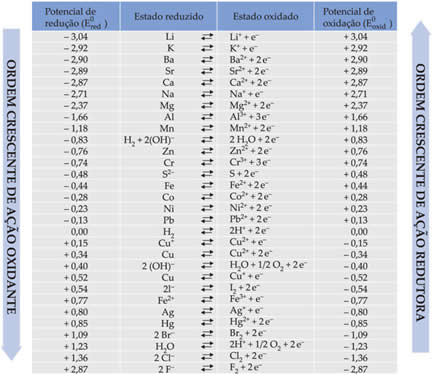
Abaixo são relacionados na tabela os potenciais conseguidos por meio desse método de utilização do eletrodo-padrão de hidrogênio, juntamente com suas respectivas semirreações:
Por Jennifer Fogaça
Graduada em Química
Equipe Brasil Escola

