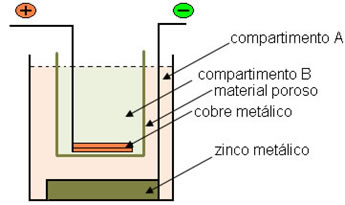
Pilha é um sistema em que a energia química é transformada de modo espontâneo em energia elétrica.
Em 1836, o químico e meteorologista inglês John Frederic Daniell (1790-1845) construiu uma pilha diferente da até então conhecida na época: a pilha de Alessandro Volta. Nesta pilha ele interligou dois eletrodos, que eram sistemas constituídos por um metal imerso em uma solução aquosa de um sal formado pelos cátions desse metal.
Um dos eletrodos, o eletrodo de cobre, era constituído de uma placa de cobre mergulhada em uma solução de sulfato de cobre (CuSO4). O outro eletrodo era o de zinco, constituído de uma placa de zinco mergulhada em uma solução de sulfato de zinco (ZnSO4).
Esses dois eletrodos foram interligados por um circuito elétrico que continha uma lâmpada, pois se ela acendesse, indicaria o surgimento de uma corrente elétrica.
Além disso, havia uma ponte salina entre elas. Essa ponte era constituída de um tubo de vidro em U contendo uma solução aquosa concentrada de um sal bastante solúvel, como o cloreto de potássio (KCl(aq)),por exemplo. As extremidades do tubo são revestidas com um algodão ou com ágar-ágar.
Abaixo temos a estrutura dessa pilha ou cela eletroquímica, que ficou conhecida como pilha de Daniell. Lembrando que cada eletrodo recebe a denominação de semicela.
Com o circuito fechado, a lâmpada se acende e após, algum tempo, a placa de zinco é corroída e tem a sua massa diminuída, já na de cobre ocorre o contrário, sua massa aumenta (conforme a figura abaixo). Nota-se também que há um aumento da concentração em mol/L dos íons Zn2+ e uma diminuição dos íons Cu2+.
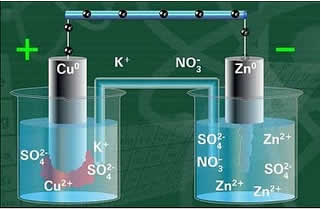
Esquema da Pilha de Daniell.
Por que isso ocorre?
Para entendermos, vejamos as reações que ocorrem em cada eletrodo separadamente.
No eletrodo de Zinco ocorre a seguinte reação em equilíbrio:
Zn( s) ↔ Zn2+(aq) + 2 e-
Isso significa que o zinco metálico (da placa) sofre oxidação, isto é, doa dois elétrons para o cátion zinco (da solução) e se transforma em Zn2+. O inverso também ocorre, o cátion zinco presente na solução recebe os dois elétrons doados pelo zinco e se transforma em zinco metálico. Ocorre, portanto, um processo de oxidação e redução ininterrupto.
O mesmo se aplica ao eletrodo de cobre, que terá a reação global em equilíbrio dinâmico: Cu( s) ↔ Cu2+(aq) + 2 e-
Daniell percebeu que se ligasse esses dois eletrodos, o mais reativo doaria seus elétrons para o cátion menos reativo em vez de fazer isto com os cátions da sua própria solução. Neste caso, o zinco é o mais reativo e sofre oxidação, doando os elétrons para o cobre, por isso a diminuição da sua massa. O eletrodo que sofre oxidação é o polo negativo, chamado de ânodo. O eletrodo de cobre é o que sofre a redução, o cátion cobre recebe os dois elétrons do zinco, e é denominado cátodo (polo positivo).
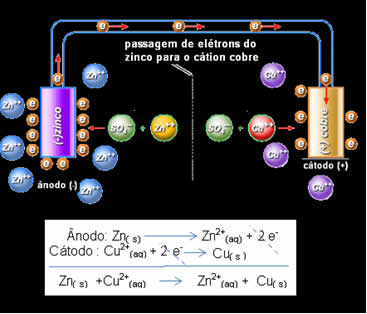
Passagem de elétrons e equação global da Pilha de Daniell.
Acima temos a equação global dessa pilha, que é obtida pela soma das duas semirreações. Sua representação ou notação química é feita obedecendo a seguinte regra:

Assim, para a pilha de Daniell temos:
Zn / Zn2+// Cu2+ / Cu
Por Jennifer Fogaça
Graduada em Química
Equipe Brasil Escola