O manganês, símbolo Mn, é o elemento de número atômico 25 da Tabela Periódica. Quimicamente, ele se destaca pela sua grande variedade de estados de oxidação, podendo variar do -3 ao +7. Em sua forma metálica, é quebradiço, porém duro e com uma coloração acinzentada.
O manganês é um elemento muito utilizado na confecção do aço e também está presente nos eletrólitos das pilhas secas e alcalinas, além constar em um dos oxidantes mais usados da Química, o permanganato de potássio.
É um elemento necessário para nossa dieta, sendo recomendados 2,3 mg/dia para adultos. Apesar de ter sido isolado no século XVIII, sua utilização já era feita pelo ser humano há muito mais tempo.
Saiba mais: Itérbio — um metal de coloração prateada, dúctil e maleável
Tópicos deste artigo
- 1 - Resumo sobre manganês
- 2 - Propriedades do manganês
- 3 - Características do manganês
- 4 - Onde o manganês pode ser encontrado?
- 5 - Obtenção do manganês
- 6 - Aplicações do manganês
- 7 - Alimentos ricos em manganês
- 8 - História do manganês
- 9 - Exercícios resolvidos sobre manganês
Resumo sobre manganês
-
O manganês é um metal de transição pertencente ao grupo 7 da Tabela Periódica.
-
Em sua forma metálica, é quebradiço, porém bastante duro, com coloração acinzentada.
-
Destaca-se por seu grande número de estados de oxidação possíveis: -3 a +7.
-
É bastante presente na crosta terrestre, assim como no fundo do mar.
-
Pode ser obtido por métodos eletrolíticos ou por processos metalúrgicos convencionais.
-
É bastante empregado na fabricação do aço, além de estar presente na composição das pilhas secas e alcalinas.
-
O permanganato de potássio é um dos oxidantes mais utilizados na indústria química. Ele atualmente é empregado para tratamento da pele de pessoas com catapora.
-
A ingestão diária recomendada do manganês é de 2,3 mg/dia para adultos. Ele é fundamental para a manutenção da saúde, e o palmito é um dos alimentos que o contêm.
-
Foi descoberto oficialmente por Johan Gahn em 1774, mas já era previsto anteriormente por Carl W. Scheele.
Propriedades do manganês
-
Símbolo: Mn
-
Número atômico: 25
-
Massa atômica: 54,938045 u.m.a
-
Eletronegatividade: 1,55
-
Ponto de fusão: 1246 °C
-
Ponto de ebulição: 2061 °C
-
Densidade: 7,21 a 7,44 g.cm-3 (a depender da forma alotrópica)
-
Configuração eletrônica: 4s2 3d5
-
Série química: metais, grupo 7, elementos de transição, bloco d
Características do manganês

O manganês, símbolo Mn, é um metal pertencente ao grupo 7 da Tabela Periódica. Ele tem coloração cinza esbranquiçada, o que lembra o ferro, porém mais duro e quebradiço. Ele consiste de uma única espécie atômica, o isótopo 55Mn.
Quimicamente o manganês é bem reativo, sendo atacado lentamente pela água (em temperatura ambiente) e rapidamente por ácidos e pela água quente. Quando dividido finamente, ele reage com o O2 presente no ar, podendo até mesmo ser pirofórico (propenso à ignição instantânea). Já a forma maciça do metal não, a menos que seja aquecido.
Em altas temperaturas, consegue reagir com boa parte dos ametais, como N2, halogênios, C, Si e B. Alguns exemplos de reações do manganês com ácido (HCl), oxigênio, nitrogênio e cloro estão dispostos a seguir:
-
Mn + 2 HCl → MnCl2 + H2
-
3 Mn + 2 O2 → Mn3O4
-
3 Mn + N2 → Mn3N2
-
Mn + Cl2 → MnCl2
Uma característica notável do elemento manganês é a sua grande variedade de estados de oxidação possíveis, podendo variar do -3 ao +7, sendo o Mn2+ a forma mais estável. Isso porque, ao perder os dois elétrons do subnível 4s, o manganês fica com a distribuição 3d5, estabilizada pela presença de um subnível preenchido pela metade (d5).
Onde o manganês pode ser encontrado?

Estima-se que o manganês seja o 12º elemento mais abundante da crosta terrestre, cuja concentração é de aproximadamente 1 g.kg-1. Embora sejam conhecidos muitos minerais com a presença dele, poucos são utilizados para sua produção de fato. Nesse contexto, destacam-se:
-
pirolusita (MnO2);
-
rodocrosita (MnCO3);
-
manganita (MnO(OH)).
Segundo o USGS Mineral Commodity Summaries de 2022, o Brasil possui a segunda maior reserva desse metal do mundo (cerca de 270 milhões de toneladas), próximo da Austrália, mas atrás da África do Sul (630 milhões de toneladas). Contudo, o país mantém o mesmo patamar em produtividade (400 mil toneladas em 2021, correspondente a 2% da produção mundial), ficando na nona posição.

O fundo do mar tem dezenas de milhões de quilômetros quadrado cobertos por depósitos ricos em manganês, por meio de nódulos e crostas de ferromanganês (teor médio de 24% em massa de Mn). Contudo, nenhum manganês ou outro metal foi produzido dessa fonte, apesar de décadas de pesquisa e exploração.
Saiba também: Cálcio — o quinto elemento mais abundante da crosta terrestre
Obtenção do manganês
O manganês pode ser obtido por métodos eletrolíticos, como a eletrólise. Nessa técnica, pode-se empregar o sulfato de manganês II (MnSO4), por exemplo.
Também é possível ocorrer a redução dos seus óxidos com hidrogênio, alumínio, monóxido de carbono, sódio e magnésio. Por exemplo, é possível fazer a redução do dióxido de manganês até o manganês metálico pela utilização de hidrogênio, para reduzir o teor de oxigênio, e então a aplicação de alumínio, para a obtenção do manganês metálico. Todas essas reações devem ocorrer em alta temperatura.
Veja, a seguir, as reações de redução dos óxidos de manganês com o hidrogênio até a forma MnO e, posteriormente, a redução do MnO ao Mn metálico utilizando o alumínio como agente redutor.
2 MnO2 + H2 → Mn2O3 + H2O
3 Mn2O3 + H2 → 2 Mn3O4 + H2O
Mn3O4 + H2 → 3 MnO + H2O
3 MnO + 2 Al → 3 Mn + Al2O3
Aplicações do manganês
A pirolusita é misturada ao Fe2O3 e reduzida com coque para a produção da liga ferromanganês (≈ 80% em massa de Mn). Essa liga é muito utilizada na fabricação do aço, e quando este possui um teor acima dos 12% de Mn, apresentará boa resistência mecânica, sendo apropriado para maquinários de escavação e demolição, como escavadeiras e britadeiras. Aliás, o manganês não possui nenhum elemento que possa substituí-lo, sendo primordial para a produção do aço.
Fora da metalurgia, o MnO2 está muito presente nos cátodos de pilhas de Leclanché (as pilhas ácidas ou zinco-carbono) e pilhas alcalinas (mais duradouras, pois substituem o cloreto de amônio por NaOH ou KOH). Além disso, também tem uso como pigmento na indústria cerâmica, na manufatura de tintas e também de vidros (nas cores verde, rósea ou púrpura).
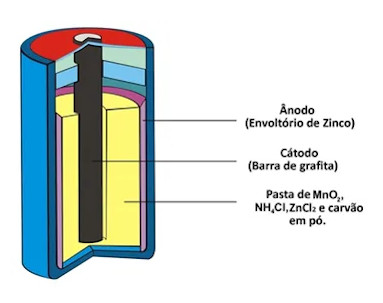
O sulfato de manganês, MnSO4, é utilizado na fabricação de fertilizantes. Além disso, destaca-se que o permanganato de potássio, KMnO4, é um dos oxidantes mais utilizados na indústria química, como na produção do ácido ascórbico (vitamina C), da niacina (ácido nicotínico) e da sacarina.
Tendo o Mn com número de oxidação +7, a forma final do manganês dependerá do pH: em meio ácido, o manganês será reduzido até a carga +2, como o íon livre Mn2+; em meio fracamente ácido a alcalino, ele estará na forma de MnO2 (carga +4); e, em meio fortemente alcalino, o Mn ficará na forma de MnO42- (carga +6).
Diversas são as reações orgânicas em que ele pode ser usado como oxidante. Exemplos bem conhecidos são as oxidações de alcenos (tanto branda quanto enérgica) e de álcoois.
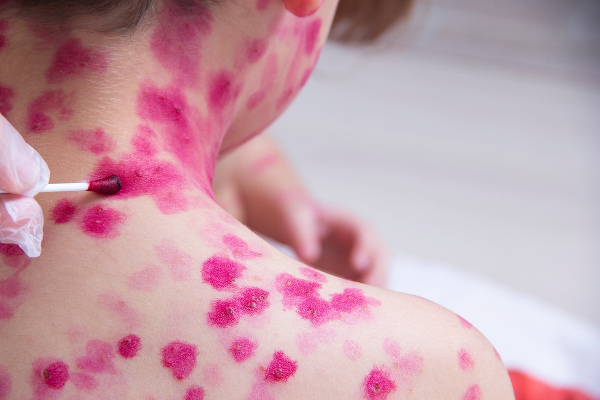
Houve época em que o permanganato de potássio era usado como desinfetante, mas, por ser agressivo à pele, acabou tendo seu uso desincentivado. Contudo, ainda se utiliza a diluição de uma parte de KMnO4 em 40.000 partes de água para a produção de uma solução de coloração rósea utilizada no tratamento de pessoas com varicela, a famosa catapora.
Leia também: Cromo — o metal de transição essencial na fabricação do aço inoxidável
Alimentos ricos em manganês
Entre os elementos de transição, o manganês é o terceiro mais importante em nossa dieta (atrás apenas de ferro e zinco). Segundo a Agência Nacional de Vigilância Sanitária (Anvisa), por meio da RDC nº 269 de 22 de setembro de 2005, a ingestão diária de manganês recomendada para adultos é de 2,3 mg por dia.
É possível ingerir manganês por meio da inclusão de cereais integrais, legumes, verduras e frutas na dieta. Destacam-se como grandes fontes de Mn:
-
o palmito (10,8 mg/100 g);
-
o nabo (4,4 mg/100 g);
-
a salsa (1,8 mg/100 g);
-
a mandioca cozida (1,6 mg/100 g);
-
a beterraba crua (1,2 mg/100 g);
-
a couve (1,02 mg/100 g).
A ausência de manganês pode causar dermatite, perda de peso, fadiga, redução da fertilidade, alteração na produção de insulina, redução da taxa de colesterol no sangue, além de intensificação de reações alérgicas e inflamatórias. Em alguns casos, inclusive, é possível causar malformações fetais.
História do manganês
A história do manganês não começa a partir do momento em que foi isolado. A pirolusita foi utilizada por artistas em pinturas rupestres na região francesa de Lascaux, há cerca de 30.000 anos. O autor romano Plínio, o Velho, que morreu ao tentar observar a erupção do vulcão Vesúvio, no ano de 79 d.C, escreveu sobre um pó preto que vidreiros usavam para deixar seus produtos mais claros (provavelmente a própria pirolusita).
O manganês começa a ter seu processo de descobrimento quando o histórico químico sueco Carl Wilhelm Scheele descobriu o cloro por meio da reação do MnO2 com uma mistura de ácido sulfúrico e cloreto de sódio. Scheele e outros cientistas da época acreditavam que, nos óxidos utilizados, haveria um novo elemento. Em 1770, o austríaco Ignatius Gottfried Kaim descreveu, em sua dissertação De metallis dubiis, um metal quebradiço oriundo da reação do MnO2 com o carbono.
Contudo, se trabalho não teve tanta repercussão. Assim, em 1774, o cientista Johan Gottlieb Gahn repetiu o processo de Kaim e o melhor descreveu, tanto na parte experimental quanto na parte dos resultados. Gahn colocou o MnO2 em um cadinho com óleo e carvão, cobrindo-o e o levando ao aquecimento. Após o processo, percebeu uma amostra metálica que lembrava o ferro: era o manganês.
No que se refere ao aspecto etimológico, o nome manganês tem a mesma origem das palavras magnésio, magneto e magnésia, a região grega de Magnésia. Isso porque, nessa região, havia dois minerais negros chamados de magnes: a magnetita (Fe3O4) e a pirolusita (MnO2), que não tinha as propriedades magnéticas do óxido de ferro citado.
Assim, o magnes não magnético começou a ser chamado de magnésia negra, sendo posteriormente cunhada como manganesum. Micheli Mercati (1541-1593) chamou o dióxido de manganês de manganesa, da qual provém o nome do elemento 25 da Tabela Periódica.
Exercícios resolvidos sobre manganês
Questão 1
(Unicap PE) O manganês tem a maior quantidade de números de oxidação em seus compostos do que qualquer um dos elementos da primeira fila de elementos de transição. Quais são os mais importantes números de oxidação do manganês, ilustrados pelos seguintes óxidos:
I. óxido manganoso, MnO
II. dióxido de manganês, MnO2
III. heptóxido de manganês, Mn2O7
A) -2, -4 e -7
B) +2 e +7
C) +2, +3 e +9
D) +2, +4 e +7
E) +2, +4 e +14
Resposta:
Alternativa D
O NOx será calculado da seguinte forma:
I. MnO: x – 2 = 0 → x = +2
II. MnO2: x + 2(-2) = 0 → x – 4 = 0 → x = +4
III. Mn2O7: 2x + 7(-2) = 0 → 2x – 14 = 0 → 2x = 14 → x = +7
Questão 2
(Unimontes MG) O manganês é um elemento que pode encontrar-se em vários estados de oxidação e, em uma reação, pode ocasionar o aumento do número de oxidação de uma outra substância e, consequentemente, ser reduzido. Entre os compostos de manganês, o melhor agente oxidante é
A) KMnO4.
B) K2MnO4.
C) MnO2.
D) MnF3.
Resolução:
Alternativa A
Agente oxidante é quem faz a oxidação de outro elemento. Para o Mn ser um bom agente oxidante, ele deve estar com o maior NOx possível, de modo que a oxidação não seja possível, mas sim apenas a redução.
Entre todas as espécies, é no KMnO4 que o manganês apresenta o maior NOx (+7), sendo então o melhor agente oxidante entre os compostos de manganês citados.
Stéfano Araújo Novais
Professor de Química

