Ácidos são substâncias que se ionizam em meio aquoso e são bons condutores de energia. Pode-se aferir a acidez de uma substância por meio de técnicas de medição do potencial hidrogeniônico (pH) de uma solução. Alguns métodos analíticos de pH utilizam indicadores como tornassol ou fenolftaleína, que refletem o valor do pH da solução na cor.
Os ácidos podem ser caracterizados:
-
pela presença ou não de oxigênios na sua molécula;
-
pela força;
-
pelos hidrogênios ionizáveis;
-
pela sua volatilidade.
Leia também: Comparação entre ácidos e bases – diferenças e propriedades
Tópicos deste artigo
- 1 - Características dos ácidos
- 2 - Potencial hidrogeniônico (pH)
- 3 - Classificação dos ácidos
- 4 - Nomenclatura dos ácidos
- 5 - Ácidos no dia a dia
- 6 - Exercícios resolvidos
Características dos ácidos
-
Ionizam-se em meio aquoso, liberando o cátion H+.
-
São condutores de eletricidade devido à liberação de íons em meio aquoso.
-
Em contato com meio básico, sofrem reação de neutralização, formando como produtos dessa reação sal e água.
-
Alteram a cor da solução na presença de substância indicadora, como tornassol ou fenolftaleína.
-
O sabor azedo do limão, laranja, entre outras frutas cítricas, deve-se ao ácido presente nesses alimentos.
Potencial hidrogeniônico (pH)
O potencial hidrogeniônico (pH) é um cálculo que expressa a concentração de íons de hidrogênio em uma determinada solução. Para determinação do pH e análise do meio, leva-se em consideração:
-
a lei de diluição de Ostwald (quanto mais diluído, mais haverá a formação de íons na solução);
-
autoionização da água (Kw), que é o desdobramento natural da molécula H2O em íons H+ e OH-;
-
água destilada a 25° C possui autoionização Kw = 10-14 e mesma concentração de íons H+ e OH-, ou seja, é um meio neutro.
Para cálculo de pH envolvendo concentração H+, usa-se: pH = -log[H+].
Saiba que:
-
pH > 7 → solução básica
-
pH < 7 → solução ácida
-
pH = 7 ou pH = pOH → solução neutra
Veja também: Como são as fórmulas dos ácidos?

Classificação dos ácidos
A classificação dos ácidos pode ser feita levando-se em conta quatro critérios diferentes.
-
Grau de ionização (α) ou força ácida
α = número de moléculas ionizadas
número de moléculas dissolvidas
-
Ácidos fortes: α ≥ 50%.
Exemplo: ácido sulfúrico (H2SO4) → α = 61%. -
Ácidos semifortes ou moderados: 5% < α < 50%.
Exemplo: ácido fosfórico (H3PO4) → α = 27%. -
Ácidos fracos: α ≤ 5%.
Exemplo: ácido bórico (H3BO3) → α = 0,075%.
→ Número de hidrogênio ionizável
-
Monoácido: libera um cátion H+.
-
Exemplo: ácido clorídrico (HCL);
-
Diácido: libera dois cátions H+.
Exemplo: ácido sulfídrico (H2S). -
Triácido: libera três cátions H+.
Exemplo: ácido bórico (H3BO3). -
Tetrácido: libera quatro cátions H+.
Exemplo: ácido pirofosfórico (H4P2O7).
Atenção! No caso dos hidrácidos, todos os hidrogênios da molécula são ionizáveis; mas, no caso dos oxiácidos, apenas os hidrogênios que estiverem ligados a um átomo de oxigênio são ionizáveis. Um exemplo é o ácido hipofosforoso (H3PO2), que é um monoácido, pois, apesar de ter três hidrogênios em sua composição, só libera o hidrogênio que está ligado ao oxigênio.
→ Presença do oxigênio
-
Oxiácidos: possuem oxigênio em sua estrutura.
Exemplo: ácido hipocloroso (HO Cl).
-
Hidrácidos: não possuem oxigênios em sua estrutura.
Exemplo: ácido fluorídrico (HF).
→ Volatilidade
-
Fixos: ponto de ebulição (PE) > 100°C, passando lentamente para o estado gasoso.
Exemplo: ácido sulfúrico (H2SO4) → PE = 340 ºC. -
Voláteis: ponto de ebulição < 100°C, passando com rapidez e facilidade para o estado gasoso.
Exemplo: ácido sulfídrico (H2S) → PE = -59,6°C.
Nomenclatura dos ácidos
→ Hidrácidos
Ácido + nome do ânion + ídrico
Para todos os ácidos, usa-se o termo “ácido” antes da nomenclatura que caracteriza a molécula. Nos hidrácidos, troca-se o sufixo “eto” do nome do elemento pelo “ídrico”.
Exemplos:
-
HCl → ácido clorídrico
-
HBr → ácido bromídrico
-
HF → ácido fluorídrico
→ Oxiácidos
A nomenclatura de oxiácidos varia de acordo com o número de oxidação (NOX) do elemento central. Veja a tabela a seguir:
|
NOX do elemento central |
Nomenclatura do ácido |
||
|
prefixo- |
-infixo- |
-sufixo |
|
|
+1 e +2 |
Hipo- |
-nome do ânion- |
-oso |
|
+3 e +4 |
-- |
Nome do ânion- |
-oso |
|
+5 e +6 |
-- |
Nome do ânion- |
-ico |
|
+7 |
Per |
-nome do ânion- |
-ico |
Exemplos:
-
HClO → Sabendo que o hidrogênio (H) normalmente tem NOX +1 e o oxigênio (O) tem NOX -2, para que tenhamos uma molécula de carga 0, o cloro (Cl) deve ter NOX +1, portanto a nomenclatura desse ácido é ácido hipocloroso.
-
HNO2 → ácido nitroso
-
HClO4 → ácido perclórico
→ Exceções à regra
-
H2CO3 → ácido carbônico, e não carbonoso, como ficaria pela regra do NOX.
-
H3BO3 → ácido bórico, e não boroso.
Ácidos no dia a dia
-
Fertilizantes e medicamentos: O ácido fosfórico (H3PO4) é muito utilizado na fabricação de fertilizantes e também como medicamento. É um dos vários ácidos que são utilizados na área farmacêutica.
-
Frutas cítricas: possuem o ácido ascórbico (C6H8O6), também conhecido como vitamina C.
-
Vinagre: tem em sua composição ácido acético (CH3COOH).
- Água com gás e refrigerantes: compostos por ácido carbônico (H2CO3), que dá ao produto a sensação de refrescância.
Acesse também: Função dos ácidos nos refrigerantes

Exercícios resolvidos
Questão 1 - (Enem) O suco extraído do repolho roxo pode ser utilizado como indicador do caráter ácido (pH entre 0 e 7) ou básico (pH entre 7 e 14) de diferentes soluções. Misturando-se um pouco de suco de repolho e da solução, a mistura passa a apresentar diferentes cores, segundo sua natureza ácida ou básica, de acordo com a escala abaixo.
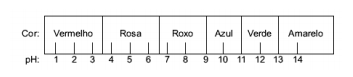
Algumas soluções foram testadas com esse indicador, produzindo os seguintes resultados:
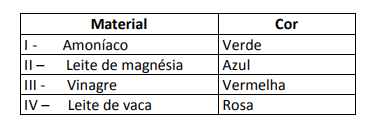
De acordo com esses resultados, as soluções I, II, III e IV têm, respectivamente, caráter:
A) ácido / básico / básico / ácido.
B) ácido / básico / ácido / básico.
C) básico / ácido / básico / ácido.
D) ácido / ácido / básico / básico.
E) básico / básico / ácido / ácido.
Resolução
Alternativa E. Para determinar se a substância tem caráter ácido, básico ou ainda neutro, faz-se uma análise das cores obtidas no teste em relação aos dados da escala dada. Sabendo que soluções com pH = 7 são neutras, pH > 7 são básicas e com pH < 7 são ácidas, chegamos à conclusão de que o amoníaco e o leite de magnésia são substâncias básicas, e o vinagre e o leite de vaca são ácidos.
Questão 2 - (PUC-Camp) A respeito das substâncias denominadas ácidos, um estudante anotou as seguintes características:
I - têm poder corrosivo;
II - são capazes de neutralizar bases;
III - são compostos por dois elementos químicos;
IV - formam soluções aquosas condutoras de corrente elétrica.
Ele cometeu erros SOMENTE em
A) I e II
B) I e III
C) I e IV
D) II e III
E) III e IV
Resolução
Alternativa B. Nem todos os ácidos são corrosivos, apenas aqueles mais fortes, e os ácidos podem ser compostos por dois ou mais átomos.
Por Laysa Bernardes
Professora de Química




