O tecnécio é um elemento de número atômico 43 pertencente ao grupo 7 da Tabela Periódica. É um metal de transição e foi o primeiro elemento a ser produzido artificialmente na história da humanidade. Até hoje debate-se se o metal pode ser encontrado naturalmente na crosta terrestre.
Esse elemento tem grande utilização na medicina nuclear, visto que possui um isótopo capaz de produzir imagens utilizadas para o diagnóstico de tumores em diversos órgãos do corpo humano. Embora sua química não seja tão desenvolvida, o interesse nele se dá por causa da medicina nuclear.
Leia também: Nióbio — um outro metal de transição
Tópicos deste artigo
- 1 - Resumo sobre o tecnécio
- 2 - Propriedades do tecnécio
- 3 - Características do tecnécio
- 4 - Ocorrência do tecnécio
- 5 - Obtenção do tecnécio
- 6 - Aplicações do tecnécio
- 7 - Precauções com o tecnécio
- 8 - História do tecnécio
- 9 - Exercícios resolvidos sobre o tecnécio
Resumo sobre o tecnécio
- O tecnécio foi o primeiro elemento a ser produzido artificialmente.
- Quimicamente, esse metal é muito semelhante ao rênio, também do grupo 7.
- Especula-se a presença de tecnécio na crosta terrestre, mas sua produção ainda é totalmente artificial.
- O elemento é amplamente utilizado na medicina nuclear para o diagnóstico de tumores e desenvolvimento de imagens de diversos órgãos.
- Sua descoberta ocorreu no ano de 1937, pelo grupo do cientista italiano Emilio Segrè.
Propriedades do tecnécio
- Símbolo: Tc.
- Número atômico: 43.
- Massa atômica: 98 u.m.a.
- Configuração eletrônica: 5s2 4d5.
- Ponto de fusão: 2157 °C.
- Ponto de ebulição: 4265 °C.
- Densidade: 11,50 g.cm-3.
- Série Química: metal de transição; grupo 7.
Características do tecnécio
O tecnécio é um elemento originalmente artificial, o primeiro a ser produzido pela humanidade. Já se produziu tecnécio metálico na faixa de quilogramas, inicialmente por meio da redução do Tc2S7 a 1100 °C com gás hidrogênio. Atualmente, é mais comum a redução do pertecnetato de amônio (NH4TcO4), também com gás hidrogênio.
Na sua forma metálica, o tecnécio é cinza prateado e escurece lentamente em contato com o ar. Destaca-se que sua química é similar à do rênio, elemento localizado logo abaixo no grupo 7. Por exemplo, quando divididos, ambos conseguem queimar em contato com o ar em uma temperatura de cerca de 370 °C. Também possuem em comum a capacidade de reagir com halogênios.
O tecnécio não se dissolve em ácido clorídrico em nenhuma concentração, mas se dissolve em:
- ácido nítrico;
- água régia (uma mistura dos ácidos nítrico e clorídrico em grande concentração);
- ácido sulfúrico.
Os estados de oxidação mais comuns para o tecnécio variam de 0 a +7, porém boa parte da química do tecnécio tem o ânion pertecnetato (TcO4-) como precursor.
Atualmente, são catalogados 43 isótopos do tecnécio, cujas massas variam de 86 a 113. Entre alguns exemplos desses isótopos estão o 97Tc, com meia-vida de 2,6 x 106 anos, e o 98Tc, com meia-vida de 4,2 x 106 anos. O isótopo mais quimicamente explorado é o 99Tc, com meia-vida de 2,1 x 105 anos.
Veja também: Bário — outro elemento de coloração prateada
Ocorrência do tecnécio
É comum afirmar que o tecnécio não ocorre naturalmente em nosso planeta, sendo apenas preparado de forma sintética. Contudo, em 1956, o químico japonês Paul Kuroda previu que uma espécie de reator nuclear natural poderia ter existido nas profundezas do planeta.
Cinco anos depois, em 1961, Kuroda reportou a presença de 99Tc em uma amostra de pechblenda (um mineral rico em urânio), cujo teor seria da ordem de 2 x 10-10 gramas do isótopo por quilograma de mineral.

Posteriormente, em 1962, pesquisadores franceses confirmaram as teorias de Kuroda ao avaliarem amostras rochosas no Gabão e, inclusive, indicaram a presença de traços de tecnécio nas amostras. Assim, a ideia de que não existe tecnécio natural é contraditória, passível de grande discussão entre a comunidade científica.
Em relação ao espaço, tecnécio foi detectado nas chamadas estrelas vermelhas gigantes, na década de 1950, mas não no Sol, algo que ajuda a comprovar que o Sol é uma estrela relativamente nova. A detecção de tecnécio nessas estrelas foi muito importante, pois o tempo de meia-vida do elemento é bem menor que a idade desses astros, sugerindo-se que, na verdade, o tecnécio está sendo produzido nesses corpos celestes.
Obtenção do tecnécio
Embora haja a discussão acerca da presença natural ou não de tecnécio em nosso planeta, é fato que a produção de tecnécio ocorre por vias artificiais em usinas nucleares. Ele corresponde a cerca de 6% dos produtos da fissão do urânio, sendo recuperado muitos anos depois.
Sua recuperação ocorre de modo que dê tempo para que produtos de fissão de pequena meia-vida e altamente radioativos tenham decaído. Em geral, o tecnécio é separado dos demais produtos de fissão por meio de resinas de troca iônica ou por extração com solvente.
Saiba também: Dúbnio — elemento artificial altamente radioativo
Aplicações do tecnécio
O principal uso do tecnécio ocorre na medicina nuclear, especificamente no diagnóstico de tumores. Para isso, utiliza-se o decaimento do isótopo 99mTc, que corresponde ao isótopo metaestável do 99Tc. A forma metaestável é a forma excitada do isótopo tradicional, ou seja, mais energética, com propriedades nucleares distintas.

Para fins medicinais, injeta-se o 99mTc no paciente na forma de uma solução salina que será absorvida pelo órgão a ser avaliado. Esse isótopo é produzido a partir do molibdênio-99 (99Mo), também sintético, formando o ânion [99MoO4]2-, que decai, emanando partículas β, e produz o [99mTcO4]-, forma química utilizada para ser injetada no paciente.
Esse isótopo metaestável é muito apropriado para esse fim, pois, depois de injetado, ele decai normalmente para o isótopo 99Tc, emitindo radiação gama (energia) suficiente para obter o resultado se for utilizada pouquíssima quantidade do isótopo metaestável, algo em torno de 1 x 10-9 a 1 x 10-12 mols.
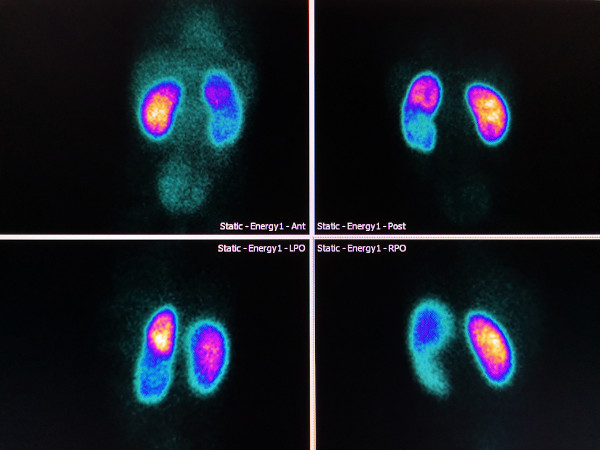
Algo igualmente vantajoso é o tempo de meia-vida do 99mTc — da faixa de seis horas. Essa meia-vida é grande o suficiente para que a amostra seja injetada no paciente antes de qualquer decaimento, mas suficientemente pequena para que as emissões sejam mensuráveis em concentrações pequenas do isótopo.
Toda radiação gama liberada é utilizada para gerar uma imagem, a qual pode ser:
- bidimensional (para avaliar tumores e metástase);
- tridimensional (para criar imagens do coração, ossos, fígado, rins e cérebro).
Precauções com o tecnécio

É preciso se atentar à radioatividade do tecnécio, principalmente para que sua manipulação seja adequada. Em quantidades pequenas, como menos de 0,05 gramas, os riscos apresentados não são tão sérios, embora seja necessária a adoção de precauções. Por exemplo, a radiação gama, mais perigosa, é quase inexistente, porém as emissões beta são facilmente contidas por vidro.
Deve-se lembrar também que os isótopos do tecnécio possuem uma grande meia-vida. Por isso, a quantidade de radiação gerada é pequena em um curto intervalo de tempo, o que reforça ainda mais a necessidade de se trabalhar em pequenas quantidades.
Uma das formas de se manipular o tecnécio envolve a utilização de uma capela de luvas, de forma que a amostra fique isolada e o operador não esteja exposto a riscos associados à radiação.
Saiba mais: Quais elementos da Tabela Periódica são radioativos?
História do tecnécio
O grupo 7 da Tabela Periódica chamou a atenção por muito tempo, uma vez que, no desenvolvimento da tabela original por Dmitri Mendeleev, apenas um elemento químico constava nele: o manganês. Assim, no século XX, muitas tentativas foram feitas para que os elementos do grupo 7 fossem descobertos, a maioria delas, obviamente, ineficaz.
Em 1925, contudo, Otto Berg, Walter Noddack e Ida Tacke (depois Ida Noddack) afirmaram terem descoberto não um, mas dois novos elementos do grupo 7, os quais eles nomearam de masúrio (Z = 43) e rênio (Z = 75). O segundo foi aceito, porém o elemento 43 não teve o mesmo acatamento, sendo alvo de muitas disputas.
Diante de muitos impasses, a descoberta oficial do elemento 43 foi creditada ao italiano Emilio Segrè, que teve ajuda de seu grupo de pesquisadores, em 1937. Segrè e sua equipe obtiveram sucesso por meio da manipulação de uma amostra de molibdênio, que foi bombardeada por deutério por vários meses.
Após diversas análises, o time italiano conseguiu identificar esse novo elemento, o qual podia ser separado por ebulição com hidróxido de sódio e uma pequena quantidade de peróxido de hidrogênio.
|
O nome tecnécio vem do grego technetos e significa “artificial”. |
Exercícios resolvidos sobre o tecnécio
Questão 1
(ESCS-DF 2011) Na medicina nuclear, são utilizados radiofármacos no diagnóstico e tratamento de várias doenças. Alguns radiofármacos utilizam o tecnécio-99m (Tc-99m), que possui propriedades úteis como um marcador nuclídeo emissor-gama e pode ser utilizado em exames do cérebro, do miocárdio, da tireoide, dos pulmões e outros.
A utilização de um radioisótopo depende das suas propriedades químicas e biológicas, inclusive do seu tempo de meia vida. O isótopo 99mTc possui tempo de meia-vida de seis horas, adequado para que se acumule no órgão que se quer estudar e para que não permaneça muito tempo no organismo.
A massa de 99mTc, necessária para realizar um determinado exame, corresponde a 500 mg. Considerando que um paciente realizará esse exame 12 horas após o radionuclídeo ser administrado, a quantidade mínima do radiofármaco que o paciente deverá receber é igual a:
A) 2 g
B) 1 g
C) 500 mg
D) 250 mg
E) 125 mg
Resolução:
Alternativa A
Meia-vida é o tempo necessário para que a quantidade de uma amostra radioativa caia pela metade. O paciente realizará o exame 12 horas após a administração do 99mTc, que possui tempo de meia-vida de seis horas.
Se são necessários 500 mg, quer dizer que após 12 horas, apenas 500 mg do 99mTc estarão disponíveis. Em 12 horas, dois tempos de meia-vida passaram, o que significa que a amostra caiu pela metade duas vezes, ou seja, a quantidade original foi dividida por quatro.
Assim, a quantia inicial de radiofármaco que o paciente deve receber é de, no mínimo, 2 gramas, pois após 12 horas, restarão apenas 500 mg de amostra.
Questão 2
(Fameca-SP 2014) A figura mostra um gerador de 99mTc (tecnécio-99 metaestável) produzido no Brasil pelo Ipen. Esse radionuclídeo, utilizado na medicina nuclear, é produzido continuamente pelo decaimento do radionuclídeo “pai”, que é o 99Mo (molibdênio-99). O gráfico mostra uma atividade típica de 99Mo desses geradores, em função do tempo em dias.
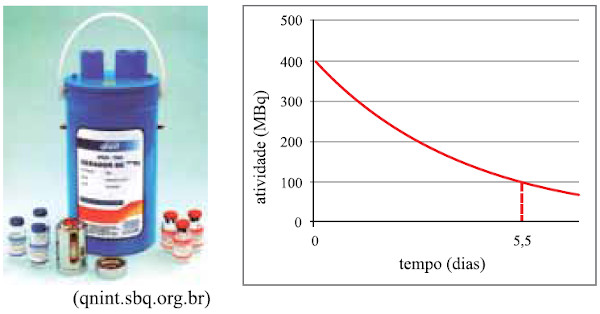
Na equação nuclear referente ao decaimento do 99Mo, nuclídeo “pai”, para o 99mTc, nuclídeo “filho”, há liberação de
A) partículas alfa.
B) partículas beta negativas.
C) partículas beta positivas.
D) nêutrons.
E) prótons.
Resolução:
Alternativa C
Tanto o 99Mo quanto o 99mTc possuem a mesma massa. O “m” no 99mTc apenas significa que se trata de um isótopo metaestável, ou seja, que está localizado em um nível energético maior que o isótopo 99Tc convencional, porém sem qualquer interferência na massa.
O molibdênio tem número atômico igual a 42, enquanto o tecnécio tem número atômico igual a 43.
Assim, percebe-se que no decaimento do 99Mo para a produção do 99mTc houve manutenção da massa e acréscimo de uma unidade no número atômico. Isso é característico de emissão de partículas beta negativas, pois essas partículas possuem massa desprezível e número atômico igual a -1, tal qual o elétron.
Por Stéfano Araújo Novais
Professor de Química

