Você sabe o que é NOX? O NOX ou número de oxidação é uma ferramenta importante no estudo da Química, sobretudo quando falamos sobre reações de oxirredução, visto que ele representa a carga elétrica que um átomo teria se os elétrons de suas ligações fossem distribuídos de forma desigual, seguindo regras específicas.
Desse modo, imagine o NOX como uma “etiqueta” que nos ajuda a entender como os elétrons são transferidos entre os átomos durante uma reação química. Dessa forma, saber calculá-lo nos ajuda a prever o comportamento de substâncias em reações, identificar agentes oxidantes e redutores, e até mesmo balancear equações químicas de forma correta.
Leia também: Afinal, o que são reações químicas?
Tópicos deste artigo
- 1 - Resumo sobre o NOX
- 2 - O que significa NOX?
- 3 - Como calcular o NOX?
- 4 - Tabela de NOX dos elementos
- 5 - Exercícios resolvidos sobre NOX
Resumo sobre o NOX
- O NOX é uma ferramenta quantitativa que auxilia na compreensão da estequiometria e na previsão do comportamento químico das substâncias.
- Representa a carga elétrica que um átomo teria se os elétrons fossem completamente transferidos durante a formação de ligações químicas.
- Auxilia na identificação de processos de oxidação (NOX aumenta) e redução (NOX diminui).
- Para determinar o NOX de elementos desconhecidos em composto, é feito um cálculo com base nos NOX conhecidos.
- Metais alcalinos e alcalinos-terrosos, alumínio e zinco têm NOX fixos.
- Substâncias simples têm NOX zero.
- O hidrogênio tem NOX +1, exceto em hidretos metálicos, cujo NOX é -1.
- O oxigênio apresenta NOX -2, contudo em peróxidos é -1.
- Em compostos iônicos, o NOX equivale à carga do íon.
- A soma dos NOX dos átomos de uma molécula neutra deve ser zero, e, em íons, deve ser igual à carga do íon.
- O cálculo do NOX auxilia na compreensão de reações químicas, como a oxirredução.
O que significa NOX?
O NOX é um termo usado na Química para se referir ao número de oxidação de um elemento em um composto. Em outras palavras, ele indica a carga elétrica que um átomo teria se os elétrons fossem completamente transferidos durante a formação de uma ligação química, ou seja, quantos elétrons um átomo ganhou, perdeu ou compartilhou. Além disso, nos ajuda a compreender reações químicas, sobretudo as de oxirredução, pois permite identificar quais elementos sofrem oxidação (aumento do NOX) e quais sofrem redução (diminuição do NOX).
Como calcular o NOX?
Para calcular o NOX de um elemento em dado composto, é necessária a aplicação de algumas regras simples baseadas na distribuição de cargas e na natureza das ligações químicas, quais sejam:
- Substâncias simples têm NOX zero, como O2, N2 e Fe.
- Metais alcalinos (grupo 1) sempre apresentam NOX +1, enquanto os metais alcalino-terrosos (grupo 2) têm NOX +2.
- Outros metais com NOX fixo: Al = +3 e Zn = +2.
- O hidrogênio normalmente tem NOX +1, exceto em hidretos metálicos, nos quais assume -1, como é caso do hidreto de sódio: NaH.
- O oxigênio geralmente apresenta NOX -2, com exceção dos peróxidos (NOX -1) e do fluoreto de oxigênio (NOX +2).
- Em compostos iônicos, o NOX equivale à carga do íon.
- A soma dos números de oxidação de todos os átomos de uma molécula ou íon deve ser igual à carga total da espécie.
Sendo assim, para calcular o NOX em um composto desconhecido, atribui-se os valores conhecidos aos elementos com regras fixas e resolve-se a equação considerando-se que a soma total deve ser neutra (para moléculas) ou igual à carga do íon (para íons). Por exemplo, no ácido sulfúrico (H2SO4), temos:
H = +1 O = -2, S = ?
Ao resolver a equação:
\(H_2SO_4\)
\(2 \cdot (+1) + S + 4 \cdot (-2) = 0 \)
\(S = + 6\)
Obtém-se NOX +6 para o enxofre.
Vajamos outros exemplos para praticar a determinação do NOX desconhecido:
a) HPO42-
H = +1 P = ? O = -2 carga do íon = -2
\(HPO_4^{2-}\)
\(1\cdot (+1)+P+4\cdot (-2) = -2\)
\(P =-2+7\)
\(P=+5\)
b) HCO3-
H = +1 C = ? O = -2
\(HCO_3^-\)
\(1\cdot(+1)+C+3\cdot(-2)=-1\)
\(C = -1+5\)
\(C=+4\)
c) Ca(NO3)2
Ca = +2 N = ? O = -2
\(Ca(NO_3)_2\)
\(1\cdot(+2)+2\cdot N+6(-2) = 0\)
\(2N = +10\)
\(N = \frac{10}{2}\)
\(N = + 5\)
d) AlPO4
Al = +3 P = ? O = -2
\(AIPO_4 \)
\(1\cdot(+3)+P+4\cdot(-2) = 0\)
\(P = +5\)
Diante disso, é possível perceber que calcular o NOX é um processo sistemático que exige o conhecimento das regras básicas e a aplicação da lógica matemática para equilibrar cargas dentro do composto.
Tabela de NOX dos elementos
A seguir, uma tabela com vários elementos químicos e seus respectivos números de oxidação (NOX) mais comuns.
|
Elemento |
Símbolo |
NOX |
Elemento |
Símbolo |
NOX |
|
Hidrogênio |
H |
+1, -1 |
Estrôncio |
Sr |
+2 |
|
Hélio |
He |
0 |
Ítrio |
Y |
+3 |
|
Lítio |
Li |
+1 |
Zircônio |
Zr |
+2, +3, +4 |
|
Berílio |
Be |
+2 |
Nióbio |
Nb |
+3, +5 |
|
Boro |
B |
+3 |
Molibdênio |
Mo |
+2, +3, +4, +5, +6 |
|
Carbono |
C |
-4, -3, -2, -1, 0, +1, +2, +3, +4 |
Tecnécio |
Tc |
+4, +6, +7 |
|
Nitrogênio |
N |
-3, -2, -1, 0, +1, +2, +3, +4, +5 |
Rutênio |
Ru |
+2, +3, +4, +6, +8 |
|
Oxigênio |
O |
-2, -1, 0, +1, +2 |
Ródio |
Rh |
+2, +3, +4 |
|
Flúor |
F |
-1 |
Paládio |
Pd |
+2, +4 |
|
Neônio |
Ne |
0 |
Prata |
Ag |
+1 |
|
Sódio |
Na |
+1 |
Cádmio |
Cd |
+2 |
|
Magnésio |
Mg |
+2 |
Índio |
In |
+1, +3 |
|
Alumínio |
Al |
+3 |
Estanho |
Sn |
+2, +4 |
|
Silício |
Si |
-4, +2, +4 |
Antimônio |
Sb |
-3, +3, +5 |
|
Fósforo |
P |
-3, 0, +1, +3, +5 |
Telúrio |
Te |
-2, +4, +6 |
|
Enxofre |
S |
-2, 0, +2, +4, +6 |
Iodo |
I |
-1, 0, +1, +3, +5, +7 |
|
Cloro |
Cl |
-1, 0, +1, +3, +5, +7 |
Xenônio |
Xe |
0, +2, +4, +6, +8 |
|
Argônio |
Ar |
0 |
Césio |
Cs |
+1 |
|
Potássio |
K |
+1 |
Bário |
Ba |
+2 |
|
Cálcio |
Ca |
+2 |
Lantânio |
La |
+3 |
|
Escândio |
Sc |
+3 |
Cério |
Ce |
+3, +4 |
|
Titânio |
Ti |
+2, +3, +4 |
Praseodímio |
Pr |
+3, +4 |
|
Vanádio |
V |
+2, +3, +4, +5 |
Neodímio |
Nd |
+3 |
|
Cromo |
Cr |
+2, +3, +6 |
Promécio |
Pm |
+3 |
|
Manganês |
Mn |
+2, +3, +4, +6, +7 |
Samário |
Sm |
+2, +3 |
|
Ferro |
Fe |
+2, +3 |
Európio |
Eu |
+2, +3 |
|
Cobalto |
Co |
+2, +3 |
Gadolínio |
Gd |
+3 |
|
Níquel |
Ni |
+2, +3 |
Térbio |
Tb |
+3, +4 |
|
Cobre |
Cu |
+1, +2 |
Disprósio |
Dy |
+3 |
|
Zinco |
Zn |
+2 |
Hólmio |
Ho |
+3 |
|
Gálio |
Ga |
+3 |
Érbio |
Er |
+3 |
|
Germânio |
Ge |
-4, +2, +4 |
Túlio |
Tm |
+3 |
|
Arsênio |
As |
-3, 0, +3, +5 |
Itérbio |
Yb |
+2, +3 |
|
Selênio |
Se |
-2, 0, +4, +6 |
Lutécio |
Lu |
+3 |
|
Bromo |
Br |
-1, 0, +1, +3, +5 |
Háfnio |
Hf |
+4 |
|
Criptônio |
Kr |
0 |
Tântalo |
Ta |
+5 |
|
Rubídio |
Rb |
+1 |
Tungstênio |
W |
+2, +3, +4, +5, +6 |
|
Radônio |
Rn |
0 |
Rênio |
Re |
-1, +1, +2, +3, +4, +5, +6, +7 |
|
Frâncio |
Fr |
+1 |
Ósmio |
Os |
+2, +3, +4, +6, +8 |
|
Rádio |
Ra |
+2 |
Irídio |
Ir |
+2, +3, +4, +6 |
|
Actínio |
Ac |
+3 |
Platina |
Pt |
+2, +4 |
|
Tório |
Th |
+3, +4 |
Ouro |
Au |
+1, +3 |
|
Protactínio |
Pa |
+3, +4, +5 |
Mercúrio |
Hg |
+1, +2 |
|
Urânio |
U |
+3, +4, +5, +6 |
Tálio |
Tl |
+1, +3 |
|
Netúnio |
Np |
+3, +4, +5, +6, +7 |
Chumbo |
Pb |
+2, +4 |
|
Plutônio |
Pu |
+3, +4, +5, +6, +7 |
Bismuto |
Bi |
+3, +5 |
|
Amerício |
Am |
+2, +3, +4, +5, +6 |
Polônio |
Po |
-2, +2, +4, +6 |
|
Cúrio |
Cm |
+3, +4 |
Astato |
At |
-1, 0, +1, +3, +5, +7 |
|
Berquélio |
Bk |
+3, +4 |
Nobelício |
No |
+2, +3 |
|
Califórnio |
Cf |
+3, +4 |
Laurêncio |
Lr |
+3 |
|
Einstênio |
Es |
+3 |
Férmio |
Fm |
+3 |
|
Mendelévio |
Md |
+2, +3 |
- |
- |
- |
É importante destacar que os elementos superpesados, com número atômico acima de 103 (Z > 103), não têm estados de oxidação bem estabelecidos. Por isso, a tabela mostra aqueles valores mais consistentes relatados na literatura.
Acesse também: Oxirredução — processo químico em que há transferência de elétrons entre elementos de uma reação química
Exercícios resolvidos sobre NOX
Questão 1
(Vunesp) O ácido nítrico é obtido a partir da amônia por um processo que pode ser representado pela reação global:
NH3 (g) + 2O2 (g) → HNO3 (aq) + H2O (l)
Nessa reação, a variação do número de oxidação (\(\Delta_{nox}\)) do elemento nitrogênio é igual a:
A) 6 unidades
B) 4 unidades
C) 2 unidades
D) 8 unidades
E) 10 unidades
Resolução:
Alternativa D.
Primeiro vamos calcular o NOX do nitrogênio nos dois compostos:
- NH3: N + 3.(+1) = 0 N = -3
- HNO3: 1.(+1) + N + 3.(-2) = 0 N = +5
Agora, é só contar as unidades:
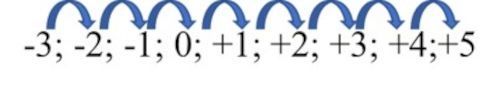
Sendo assim, houve uma variação de 8 unidades no NOX do nitrogênio.
Questão 2
Os fertilizantes nitrogenados são amplamente utilizados na agricultura para melhorar a produtividade das plantas. Um exemplo é o nitrato de amônio (NH4NO3), composto que fornece nitrogênio tanto na forma amoniacal quanto na forma nítrica. Diante disso, com base na fórmula química do nitrato de amônio, determine os números de oxidação (NOX) do nitrogênio nas duas espécies químicas presentes respectivamente e assinale a alternativa correta:
A) -3 e +5
B) +1 e -1
C) 0 e 0
D) +3 e -3.
E) -1 e +3
Resolução:
Alternativa A.
O nitrato de amônio é formado por dois íons poliatômicos: NH4+ e NO3-. Vamos então calcular o NOX do nitrogênio em cada caso.
- NH4+: N + 4.(+1) = +1 N = +1 – 4 N = -3.
- NO3-: N + 3.(-2) = -1 N = -1 +6 N = +5
Portanto, os respectivos NOX são -3 e +5.
Fontes
BROWN, T. L.; LEMAY, H. E.; BURSTEN, B. E.; MURPHY, C. J. Número de oxidação e reações de oxirredução. In: Química: A Ciência Central. 10. ed. São Paulo: Pearson Prentice Hall, 2015. p. 123–145.
ATKINS, P.; JONES, L.; LAVERMAN, L. Reações de oxirredução e números de oxidação. In: Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente. 7. ed. Porto Alegre: Bookman, 2016. p. 875–900.
FELTRE, R. Número de oxidação e reações de oxirredução. In: Química II. 8. ed. São Paulo: Moderna, 2017. p. 210–230.


