O cromo, número atômico 24, é um metal de transição localizado no grupo 6 da Tabela Periódica. Sua coloração é acinzentada, mas ele é também um metal muito lustroso. Existe principalmente nos estados de oxidação +2, +3 e +6 e possui a característica de que todos os seus compostos são coloridos. Não à toa, seu nome deriva do grego chroma, que significa cor.
Esse elemento é obtido por meio da cromita e tem grande utilização na indústria metalúrgica, na produção do aço inoxidável e outras ligas especiais. O cromo também pode ser eletrodepositado sobre objetos, em um efeito conhecido como cromagem, que garante, além de beleza, grande resistência química. Os compostos de cromo também são utilizados em pigmentos e tintas, além de materiais refratários.
Leia também: Háfnio — o metal de transição que possui propriedades semelhantes ao zircônio
Tópicos deste artigo
- 1 - Resumo sobre cromo
- 2 - Propriedades do cromo
- 3 - Características do cromo
- 4 - Onde o cromo pode ser encontrado?
- 5 - Obtenção do cromo
- 6 - Aplicações do cromo
- 7 - Relação do cromo com a saúde
- 8 - História do cromo
- 9 - Exercícios resolvidos sobre cromo
Resumo sobre cromo
-
O cromo é um metal acinzentado e lustroso que abre o grupo 6 da Tabela Periódica.
-
É muito resistente à corrosão e ao ataque químico em temperatura ambiente.
-
Apresenta, principalmente, os estados de oxidação +2, +3 e +6.
-
Todos os seus compostos possuem cor.
-
Pode ser obtido por meio da cromita, FeCr2O4.
-
É principalmente explorado pela indústria metalúrgica, que o utiliza na confecção do aço inoxidável.
-
Foi descoberto em 1797 pelo francês Louis Nicolas Vauquelin.
Propriedades do cromo
-
Símbolo: Cr.
-
Número atômico: 24.
-
Massa atômica: 51,9961 u.m.a.
-
Eletronegatividade: 1,66.
-
Ponto de fusão: 1907 °C.
-
Ponto de ebulição: 2671 °C.
-
Densidade: 7,15 g.cm-3 (a 20 °C).
-
Configuração eletrônica: 4s1 3d5.
-
Série Química: grupo 6, metais de transição.
Características do cromo
O cromo, número atômico 24, é um metal de coloração acinzentada, duro e lustroso. Em temperatura ambiente, resiste bem aos ataques químicos, como de soluções ácidas ou básicas, com exceção de HCl e H2SO4 diluídos. Porém, em maior temperatura, o cromo se torna bem mais reativo, sendo facilmente oxidado pelo O2, e se combina com os halogênios e a maioria dos ametais.
Em solução, os compostos de cromo costumam apresentar números de oxidação +6, +3 e +2. Inclusive, uma característica interessante é que todos os compostos do cromo são coloridos, como é o caso do dicromato de potássio, K2Cr2O7, que é laranja, e do cromato de potássio, K2CrO4, que é amarelo.
Um fato curioso acerca do cromo é que sua configuração eletrônica não segue o padrão esperado. Fazendo sua distribuição eletrônica, seria esperado que ela fosse 4s2 3d4, contudo, cálculos de energia e estabilidade demonstram que a configuração 4s1 3d5 é mais estável. Isso pode ser explicado pela Regra de Hund.
Segundo essa regra, quanto maior o número de elétrons com spin iguais (ou paralelos) em um orbital incompleto, menor será a energia do átomo, ou seja, maior será a estabilidade. Observe na imagem a seguir:
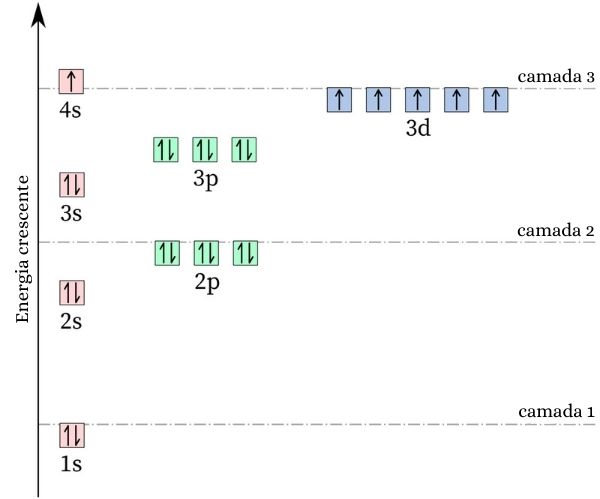
Caso o cromo adotasse a configuração 4s2 3d4, o orbital 4s apresentaria elétrons com spin opostos (↑↓), o que aumentaria a repulsão, afinal, seriam duas cargas de mesmo sinal dividindo um único orbital.
Ao adotar a configuração 4s1 3d5, o cromo mantém um número maior de elétrons com spin iguais, sem a presença de elétrons dividindo o mesmo orbital (conforme mostrado na imagem anterior), o que diminui a sua energia e lhe garante mais estabilidade.
Veja também: Vanádio — elemento químico cujas soluções também possuem cores distintas
Onde o cromo pode ser encontrado?
O cromo é o décimo elemento mais abundante da Terra. Embora existam diversos minerais que possuam cromo na sua constituição, a cromita, FeCr2O4, é o mineral mais importante do cromo, sendo o mais largamente explorado comercialmente.

É importante destacar que os países com maiores reservas de cromo são:
O Brasil é o único produtor de cromo em todo o continente americano, mas detém apenas 0,11% das reservas mundiais. As reservas se distribuem, principalmente, nos seguintes estados:
Obtenção do cromo

O cromo metálico é produzido por meio da cromita. Nesse caso, o mineral é fundido com carbonato de sódio, Na2CO3, na presença de ar, gerando cromato de sódio e óxido de ferro III:
4 FeCr2O4 + 8 Na2CO3 + 7 O2 → 8 Na2CrO4 + 2 Fe2O3 + 8 CO2
A partir daí, é feita extração com água, uma vez que o Na2CrO4 é solúvel em água, enquanto o Fe2O3 não. Depois, é feita a acidificação do meio com H2SO4, que permite a cristalização do cromato de sódio. O Na2CrO4 é reduzido a óxido de cromo III com o uso de carbono em alta temperatura:
Na2CrO4 + 2 C → Cr2O3 + Na2CO3 + CO
O cromo metálico é então obtido quando o alumínio é utilizado como agente redutor, também em alta temperatura:
Cr2O3 + 2 Al → Al2O3 + 2 Cr
Aplicações do cromo
A indústria metalúrgica é a grande consumidora de cromo, com cerca de 80% de todo o cromo produzido, seja na forma de cromita ou de concentrado de Cr2O3. Isso porque o cromo é capaz de formar a liga ferrocromo, fonte básica para a obtenção do aço inoxidável e outras ligas especiais.
O cromo, que em geral compõe 18% do aço inoxidável, aumenta consideravelmente a resistência à oxidação (corrosão) e outros ataques químicos ao aço. Em outras ligas especiais, o cromo também tem o papel de aumentar a temperabilidade, a dureza e a tenacidade dos materiais.

A indústria de refratários também é boa consumidora do cromo, pois a cromita é um conhecido material refratário, ou seja, um material capaz de resistir aos efeitos térmicos, químicos e físicos que ocorrem nas indústrias. A cromita, utilizada para a fabricação de tijolos refratários, é muito resistente à degradação quando exposta ao aquecimento.
Já a indústria química busca utilizar o cromo de diversas formas:
-
como catalisador;
-
como inibidor de corrosão;
-
em cromagem;
-
em pigmentos;
-
em compostos de tingimento.
A cromagem é muito conhecida, consistindo na formação de uma capa protetora de cromo sobre algum objeto, protegendo-o da corrosão. Nesse processo, o cromo é depositado sobre o objeto a ser cromado através da eletrólise aquosa do sulfato de cromo III, Cr2(SO4)3, produzido pela dissolução do Cr2O3 em H2SO4.
Pigmentos de cromo são muito comuns, principalmente com as diversas cores possíveis de serem obtidas com seus compostos. Na dissolução de cloreto de cromo III hexaidratado, CrCl3·6H2O, obtém-se uma solução violeta. Já na dissolução de sulfato de cromo III, Cr2(SO4)3, uma coloração verde é obtida.
A solução de cloreto de cromo II, CrCl2, é azul, enquanto o acetato de cromo II, Cr2(COO)4, é um sólido vermelho. O óxido de cromo II, CrO2, é preto; o cromato de potássio, K2CrO4, é amarelo; o dicromato de potássio, K2Cr2O7, é laranja; o tricromato de potássio, K2Cr3O10, é vermelho; e o óxido de cromo VI, CrO3, também é vermelho.
Interessante: Os rubis são, na verdade, gemas, de fórmula Al2O3, que possuem traços de cromo em sua constituição. É o caso também da esmeralda, uma forma de berilo, cuja cor verde é consequência de pequenas quantidades de cromo.
Saiba também: Tungstênio — metal acinzentado cuja coloração lembra o aço
Relação do cromo com a saúde
Dois estados de oxidação do cromo possuem papel biológico. Vejamos a seguir.
→ Cromo hexavalente (Cr6+)
No que diz respeito ao Cr6+, sabe-se que ele pode ser considerado cancerígeno, principalmente se inalado ou ingerido em grandes quantidades.
→ Cromo trivalente (Cr3+)
Já o cromo trivalente sempre foi considerado um elemento essencial. A suplementação nutricional de cromo nessa forma se tornou popular para a promoção de elemento traço essencial e como agente de perda de peso. Há também uma discussão de que a administração de cromo trivalente seria interessante para o tratamento da diabetes do tipo 2, assim como para a diabetes gestacional.
Porém, alguns autores colocam essa essencialidade em discussão. A linha de pensamento é de que o cromo, seja suplementado ou não, não faz diferença na composição corporal, no metabolismo da glicose ou na sensibilidade à insulina. Acredita-se que, na verdade, a maior dosagem de cromo tenha efeitos farmacológicos e não nutricionais para indicá-lo como elemento essencial.
História do cromo
O nome cromo vem do grego chroma, que significa cor. Tendo também dado o nome a esse elemento, sua descoberta se deu pelo farmacêutico e químico francês Louis Nicolas Vauquelin, no ano de 1797, quando ele percebeu o cromo ao estudar o minério crocoíta, PbCrO4. Contudo, inicialmente, o metal não foi um grande sucesso comercial.
Quinze anos depois de sua descoberta, por exemplo, Sir Humphry Davy não sabia muito sobre o cromo e seus compostos quando escreveu seu famoso livro Elements of Chemical Philosophy, indicando apenas que o ácido crômico tinha um sabor azedo.
No mesmo ano, Jöns Jacob Berzelius escreveu que o sabor residual do tóxico ácido crômico era desagradável e metálico. Berzelius percebeu que o metal, embora quebradiço, era bastante resistente à ação de ácidos e ao ar atmosférico.
Embora não fosse inicialmente um grande sucesso comercial, no fim do século XIX e começo do século XX, o elemento passou a ser utilizado comercialmente, pois o aço inoxidável começou a ser largamente usado, bem como a cromagem de peças da indústria automotiva, fazendo com que o cromo se tornasse um metal de grande demanda.
Exercícios resolvidos sobre cromo
Questão 1
(UEFS/BA) O átomo de cromo apresenta número de oxidação +3 na espécie
A) Cr2O3
B) CrO
C) Cr
D) CrO42-
E) Cr2O72-
Resolução:
Alternativa A
Na letra C, o cromo aparece como uma substância simples, logo, naquele caso, o NOx é igual a zero.
O oxigênio nos demais compostos ocorre com NOx igual a -2. Assim, podemos calcular o NOx do cromo em todas as espécies, fazendo-o ser a incógnita (x):
-
Cr2O3 → 2x + 3(-2) = 0 ⸫ x = +3
-
CrO → x + (-2) = 0 ⸫ x = +2
-
CrO42- → x + 4(-2) = -2 ⸫ x = +6
-
Cr2O72- → 2x + 7(-2) = -2 ⸫ x = +6
Questão 2
(UPE 2013) Um grupo internacional de cientistas descobriu uma reação química complexa, responsável pela deterioração de algumas das grandes obras artísticas da história, produzidas por Vincent van Gogh (1853–1890) e outros pintores famosos no século XIX. Em suas investigações, esses pesquisadores envelheceram os pigmentos artificialmente e verificaram que o escurecimento da camada superior estava relacionado com uma mudança do cromo presente na tinta de Cr(VI) para Cr(III).
Disponível em: http://agencia.fapesp.br/13455 (Adaptado)
Dados: Cr (Z = 24), configuração eletrônica: 4s1 3d5
Diante da situação acima relatada, é CORRETO afirmar que a(o)
A) oxidação do Cr(VI) para Cr(III) tem deteriorado grandes obras artísticas da história.
B) envelhecimento dos quadros se relaciona à excitação eletrônica do Cuo para o Cr3+.
C) processo de redução do Cr6+ para o Cr3+ tem escurecido obras famosas do século XIX.
D) transformação ocorrida tem oxidado o Cuo, responsável pelo brilho da pintura original.
E) mudança do Cr(VI) para Cr(III) é uma reação química que só acontece depois de muitos anos.
Resolução:
Alternativa C
A passagem do Cr(VI) para o Cr(III) é um processo de redução (diminuição do NOx), o que foi responsável pelo escurecimento das telas.
Por Stéfano Araújo Novais
Professor de Química

