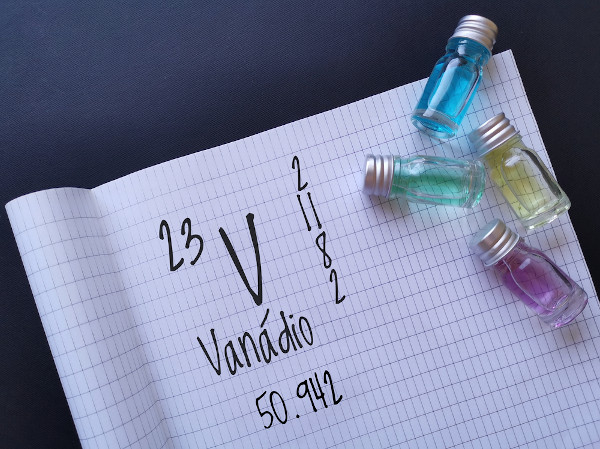O vanádio, símbolo V, é um metal de transição de número atômico 23 localizado no grupo 5 da Tabela Periódica. Ele apresenta diversos estados de oxidação possíveis, gerando soluções com cores diferentes e chamativas. O vanádio metálico possui boa resistência à corrosão e coloração acinzentada.
O elemento é majoritariamente utilizado na produção da liga ferrovanádio, que confere ao aço propriedades vantajosas, como maior resistência mecânica e à corrosão. Ele também é um importante catalisador para a indústria química, atuando em diversos processos industriais. A principal fonte do vanádio é a vanadinita, contudo, dificilmente se encontra um mineral em que o vanádio é o metal principal.
Veja também: Tântalo — outro metal do grupo 5 da Tabela Periódica
Tópicos deste artigo
- 1 - Resumo sobre o vanádio
- 2 - Propriedades do vanádio
- 3 - Características do vanádio
- 4 - Onde o vanádio pode ser encontrado?
- 5 - Obtenção do vanádio
- 6 - Aplicações do vanádio
- 7 - Precauções com o vanádio
- 8 - História do vanádio
- 9 - Exercícios resolvidos sobre o vanádio
Resumo sobre o vanádio
-
O vanádio é um metal de transição do grupo 5 da Tabela Periódica.
-
Suas principais fontes minerais são a vanadinita e carnotita, mas ele pode ser encontrado em diversas fontes naturais, como rochas fosfáticas e petróleo cru.
-
Apresenta muitos estados de oxidação possíveis.
-
É principalmente utilizado na fabricação da liga ferrovanádio.
-
Sua descoberta data do começo do século XIX e seu nome faz referência à deusa da beleza escandinava Vanadis.
Propriedades do vanádio
-
Símbolo: V.
-
Número atômico: 23.
-
Massa atômica: 50,942 u.m.a.
-
Eletronegatividade: 1,63.
-
Ponto de fusão: 1910 °C.
-
Ponto de ebulição: 3407 °C.
-
Densidade: 6,0 g.cm-3 (a 18,7 °C).
-
Configuração eletrônica: 4s2 3d3.
-
Série Química: grupo 5; metais de transição.
Características do vanádio
O vanádio é um metal macio, com boa resistência à corrosão, de coloração acinzentada. Visualmente, ele lembra o aço. Sua forma metálica é insolúvel em ácidos não oxidantes, com exceção do ácido fluorídrico (HF), e em bases. Contudo, pode ser quimicamente atacado por ácido nítrico (HNO3) e água régia (mistura de ácido clorídrico e ácido nítrico em alta concentração).

Assim como muitos metais de transição, o vanádio possui vários números de oxidação possíveis, geralmente entre +2 e +5. Contudo, sabe-se que existem compostos em que ele adota carga -1 ou até mesmo -3. Essa grande variedade de cargas possíveis é perceptível através de suas reações.
Sob aquecimento, o vanádio pode reagir tanto com o oxigênio quanto com halogênios, conforme mostram as reações a seguir:
-
4 V + 5 O2 → 2 V2O5
-
2 V + 5 F2 → 2 VF5
-
V + 2 Cl2 → VCl4
-
2 V + 3 X2 → 2 VX3, com X = Br ou I
Os sais de vanádio em que ele apresenta número de oxidação igual a +3 são bastante redutores, uma vez que o estado de oxidação +4 é o mais estável para o elemento.
O vanádio natural é uma mistura de dois isótopos, o 50 (com abundância de 0,25%) e o 51 (com abundância de 99,75%). O 50V é um pouco radioativo, com um tempo de meia-vida longo, na faixa de 3,9 x 1017 anos.
Leia também: Níquel — outro metal com boa resistência à corrosão
Onde o vanádio pode ser encontrado?
O vanádio é o 22º elemento mais abundante da crosta terrestre, com concentração estimada em 97 mg/kg de solo, sendo considerado um metal relativamente profuso. Existem cerca de 65 minerais de vanádio, mas o metal é principalmente encontrado:
-
na vanadinita, Pb5(VO4)3Cl;
-
na carnotita, K2(UO2)2(VO4)·3H2O;
-
na roscoelita, uma mica que contém vanádio;
-
na patronita, um polissulfeto de fórmula VS4.

Também se destaca o vanádio oriundo de rochas fosfáticas, magnetita titanífera, bauxita e de materiais orgânicos como:
-
carvão;
-
petróleo cru;
-
areias betuminosas.
O vanádio, aliás, é o metal mais abundante do petróleo, com teor de cerca de 1600 mg/kg. No betume, o teor de vanádio pode chegar a 4.760 mg/kg.
As reservas mundiais de vanádio superam 63 milhões de toneladas, porém, este é considerado um metal que ocorre de forma espalhada pelo planeta. Boa parte dos minerais que contêm vanádio o apresentam como um elemento secundário, sendo que quase não existem minerais em que ele é o metal principal.
Obtenção do vanádio
Boa parte do vanádio metálico é obtido por meio da sua redução utilizando óxido de vanádio V ou do cloreto de vanádio IV. Os redutores empregados são, comumente, os metais magnésio, cálcio e alumínio. Também é possível utilizar redutores não metálicos, como carbono e silício.
Dentre os elementos citados, o alumínio é o mais comum nesse contexto. Depois da redução, o vanádio precisa ser refinado, a fim de que sejam retirados os resquícios de impurezas. Para isso, geralmente é empregada uma das opções a seguir:
-
purificação por troca eletrônica;
-
decomposição térmica do iodeto de vanádio II.
No caso da redução com alumínio, por exemplo, é utilizado alumínio de alta pureza, em um método conhecido como Processo Goldschmidt, desenvolvido em 1893. Ele foi aproveitado e utilizado por Carlson para a obtenção de vanádio metálico.
3 V2O5 + 10 Al ⇌ 6 V + 5 Al2O3
Esse experimento ocorre em atmosfera de argônio, e, de início, é formada uma liga de vanádio e alumínio com cerca de 11% em massa de vanádio. Depois, em uma temperatura entre 1700–1800 °C e em vácuo, ocorre a saída do alumínio.
Em 1927, John Marden e Malcolm Rich produziram vanádio com pureza média de 99% realizando sua redução com cálcio e cloreto de cálcio. No caso, os reagentes eram colocados em um contêiner, e o sistema era então aquecido a 900–950 °C. Após o sistema resfriar, o vanádio era obtido.
V2O5 + 5 Ca + 5 CaCl2 ⇌ 2 V + 5 CaO·CaCl2
Aplicações do vanádio
Pelo menos 80% do vanádio obtido é utilizado para produção da liga ferrovanádio, usada na fabricação do aço e outras ligas. A adição de 0,1 a 5% de vanádio ao aço faz com que este interaja com o carbono e forme carbetos.
Como consequência, o aço se torna mais forte, duro e detém maior resistência ao choque e à corrosão. Em ferramentas, é comum a utilização do aço com vanádio, mas também com cromo. Aço com vanádio é, então, empregado em:
-
materiais de corte e construção;
-
setores de transporte e energia.

Fora da metalurgia, o vanádio, na coomposição V2O5, é comumente utilizado como catalisador em reações orgânicas e inorgânicas. Elas são de grande importância econômica, por exemplo,
-
na produção do ácido sulfúrico, um dos ácidos mais utilizados por toda a indústria química;
-
na conversão do naftaleno em ácido ftálico;
-
na produção de poliamidas, como o nylon;
-
na oxidação do álcool etílico a acetaldeído, açúcar a ácido oxálico e antraceno a antraquinona.
Além disso, há o desenvolvimento de baterias de vanádio, as quais vêm sendo utilizadas para o armazenamento de energia elétrica. A vantagem do vanádio é que ele pode coexistir em quatro estados de oxidação diferentes em meio aquoso, produzindo uma bateria com um único elemento eletroativo. Essas baterias também prometem ser mais duradouras, estáveis, pouco inflamáveis e geradoras de compostos de fácil reciclagem.
Biologicamente, o vanádio parece ser essencial ao ser humano, mas ainda não se sabe especificamente qual sua função. O ânion vanadato, (VO4)3-, e seus derivados são análogos ao fosfato, o que significa que compostos de vanádio são potenciais inibidores de fosfatases, ribonucleases e ATPases.
Saiba mais: Rênio — outro elemento químico utilizado na fabricação de catalisadores
Precauções com o vanádio
Trabalhadores expostos ao vanádio na forma de V2O5 em indústrias reportaram diversos sintomas, tais como:
-
irritação respiratória;
-
língua com coloração esverdeada;
-
gosto metálico na boca;
-
irritação na garganta;
-
tosse.
História do vanádio
A descoberta do vanádio data de 1801, na Cidade do México, pelo químico e mineralogista espanhol Don Andrés Manuel del Río. Ele descobriu o metal a partir do mineral vanadinita, extraído da cidade de Zimapán, México.
Por conta das cores dos compostos do vanádio, del Río deu o nome de pancrómio ao novo elemento, mas, em seguida, o chamou de eritrônio, em alusão à cor vermelha dos seus sais. Contudo, o espanhol acreditou que o novo elemento não passava de uma forma impura de cromo.
Friedrich Wöhler, um químico alemão, chegou a avaliar a vanadinita estudada por Andrés del Río e constatou que, de fato, o espanhol havia descoberto um novo elemento. Porém, especula-se que, à época, o alemão sofria com intoxicações decorrentes de exposição ao ácido fluorídrico, HF, e não permitiu a publicação dos estudos.
Com isso, o vanádio foi redescoberto em 1830 pelo químico sueco Nils Gabriel Sefström. O cientista decidiu batizar o novo elemento de vanadis, homenageando a deusa escandinava da beleza e da juventude, já que, em solução, os compostos de vanádio apresentavam sempre belas cores.
Apenas em 1867 o vanádio foi isolado pela primeira vez, através do trabalho do químico inglês Henry Enfield Roscoe, a partir do VCl2.
Exercícios resolvidos sobre o vanádio
Questão 1
(PUC Campinas-SP) Vanádio (Z = 23), elemento de transição, constitui componente importante do aço para produzir um tipo de liga que melhora consideravelmente a tenacidade, as resistências mecânicas e a corrosão do ferro. Quantos elétrons há no subnível 3d da configuração eletrônica do vanádio?
A) 1
B) 2
C) 3
D) 4
E) 5
Resolução:
Alternativa C
Ao fazer a distribuição eletrônica do elemento químico vanádio, Z = 23, temos:
1s2 2s2 2p6 3s2 3p6 4s2 3d3
Assim, o número de elétrons no subnível 3d é igual a 3.
Questão 2
O vanádio é um metal que tem grande importância para a indústria química, já que seu composto óxido de vanádio V é muito utilizado como catalisador. Dentre as alternativas, indique a que contém a fórmula molecular do óxido de vanádio V.
A) VO5
B) V2O4
C) VO3
D) V2O5
E) VO2
Resolução:
Alternativa D
O nome “óxido de vanádio V” indica que o elemento possui número de oxidação igual a +5 nesse composto. Como nos óxidos o oxigênio possui número de oxidação igual a -2, a fórmula adequada para o óxido de vanádio V é V2O5, pois é a única forma em que toda a carga positiva do vanádio é neutralizada por toda a carga negativa do oxigênio.
Por Stéfano Araújo Novais
Professor de Química