Os haletos orgânicos compõem o conjunto de substâncias orgânicas que possuem átomos de halogênio ligados à cadeia carbônica. Os halogênios são os elementos da família 17, mas, nesse caso, contaremos apenas com os átomos de:
Os haletos orgânicos são compostos por três grupos:
-
haletos de alquila (derivam de hidrocarbonetos não aromáticos);
-
haletos de arila (derivam de hidrocarbonetos aromáticos);
-
haletos de acila (derivam de ácidos carboxílicos e por isso são carbonilados).
São a base química de boa parte dos pesticidas e fungicidas, como o DDT, o BHC, a Aldrina e o Endrin. Entretanto, também já foram utilizados como anestésicos, como é o caso do clorofórmio, e fluidos refrigerantes, como é o caso do Freon.
Leia também: Ácidos carboxílicos – compostos orgânicos que apresentam carboxila
Tópicos deste artigo
- 1 - Classificação dos haletos orgânicos
- 2 - Nomenclatura dos haletos orgânicos
- 3 - Formação dos haletos orgânicos
- 4 - As propriedades dos haletos orgânicos
- 5 - Aplicações dos haletos orgânicos
- 6 - Videoaula sobre as funções orgânicas no Enem
- 7 - Exercícios resolvidos sobre haletos orgânicos
Classificação dos haletos orgânicos
Os haletos orgânicos podem ser classificados quanto à quantidade de átomos de halogênio ligados à cadeia:
-
mono-haleto: há apenas um átomo de halogênio na estrutura;
-
di-haleto: há dois átomos de halogênio na estrutura;
-
tri-haleto: há três átomos de halogênio na estrutura.
Caso existam mais átomos, o prefixo correspondente pode ser utilizado, assim como o prefixo poli-, o qual indica que há dois ou mais átomos de halogênio presentes na estrutura.
Os haletos orgânicos também podem ser classificados quanto ao tipo de cadeia carbônica:
-
haletos de alquila: a cadeia principal é de um hidrocarboneto não aromático (alifático);
-
haletos de arila (ou haletos aromáticos): a cadeia principal é de um hidrocarboneto aromático;
-
haletos de acila (ou haletos ácidos): a cadeia principal é derivada de um ácido carboxílico.
Nomenclatura dos haletos orgânicos
-
Haletos de alquila e arila
A nomenclatura oficial dos haletos de alquila e arila deve seguir a seguinte estrutura:
Quantidade de halogênio (mono, di, tri…) + nome do halogênio + nome do hidrocarboneto
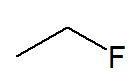
A estrutura abaixo se chama fluoretano, pois o átomo de flúor se liga à cadeia de um alcano chamado etano:
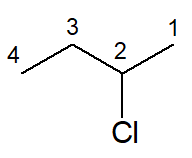
Já a estrutura a seguir se chama 2-clorobutano, muito semelhante ao exemplo anterior. A diferença é que existem outras posições possíveis para o átomo de cloro, e, sendo assim, a numeração de sua posição deve aparecer no nome oficial.
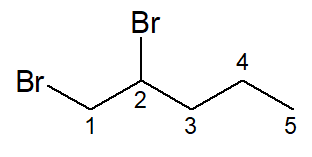
O composto a seguir é um exemplo de di-haleto de alquila: o 1,2-dibromo-pentano. Os halogênios não são considerados ramificações, por isso, podem estar nos carbonos de extremidade.
Um exemplo de haleto de arila é o 1-cloro-3-flúor-benzeno ou meta-cloro-flúor-benzeno. O cloro possui prioridade sobre o flúor na nomenclatura por conta da ordem alfabética.
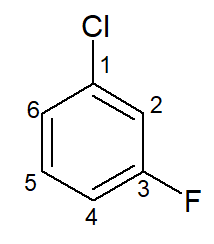
-
Haletos de acila
A nomenclatura oficial dos haletos de acila é um pouco diferente, seguindo a estrutura:
Nome do halogênio com sufixo -eto + nome da cadeia principal com sufixo -oíla
A cadeia principal dos haletos de acila sofre as mesmas regras de prefixo e infixo da química orgânica, a diferença é que o sufixo será -oíla.
A estrutura a seguir se chama brometo de butanoíla, pois o halogênio ligado à carboxila é o bromo, recebendo o sufixo -eto, e a cadeia principal possui quatro carbonos, sem ligações duplas ou triplas (por isso o infixo -an-), com o devido sufixo.
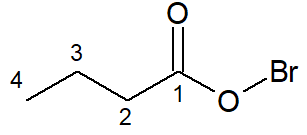
Leia também: Como funciona a nomenclatura de alcanos com mais de 10 carbonos?
Formação dos haletos orgânicos
Os haletos orgânicos podem ser formados por reações orgânicas de adição ou de substituição.
Hidrocarbonetos insaturados, como alcenos e alcinos, podem sofrer adição de halogênios na forma de substância simples ou de haletos de hidrogênio (como HCl ou Hbr), e assim se transformarem em haletos orgânicos, mais especificamente em haletos de alquila:
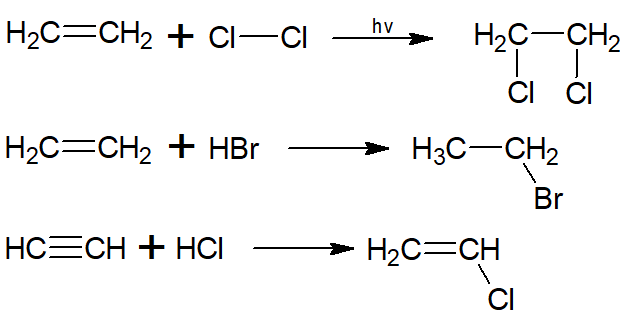
Já alcanos e hidrocarbonetos aromáticos formam haletos orgânicos por reações de substituição. No caso dos alcanos, o produto é um haleto de alquila; já no caso dos aromáticos, o produto é um haleto de arila:
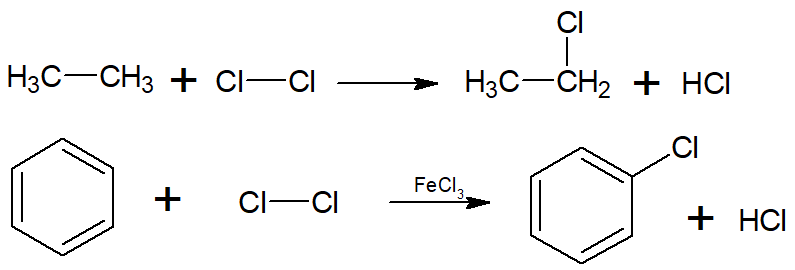
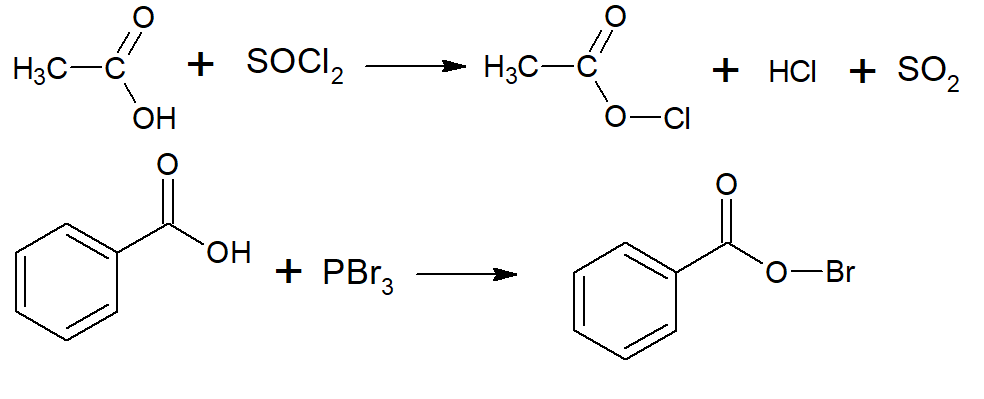
Os haletos de acila, ou haletos ácidos, também são obtidos por reações de substituição, como mostram as reações a seguir com o cloreto de tionila (SOCl2) e o tribrometo de fósforo (PBr3):
As propriedades dos haletos orgânicos
-
Polaridade dos haletos orgânicos
Os halogênios são conhecidos por seus valores elevados de eletronegatividade. O flúor, por exemplo, é considerado o elemento mais eletronegativo da Tabela Periódica. Assim como o flúor, cloro e bromo são bem mais eletronegativos que o carbono, enquanto o iodo é um pouco mais eletronegativo que o carbono. Com isso, podemos afirmar que a presença de um halogênio torna a cadeia mais polar do que se comparada a um simples hidrocarboneto. Veja o comparativo dos valores de eletronegatividade para o carbono e os demais halogênios:
|
Elemento |
Eletronegatividade |
|
Carbono (C) |
2,55 |
|
Flúor (F) |
3,98 |
|
Cloro (Cl) |
3,16 |
|
Bromo (Br) |
2,96 |
|
Iodo (I) |
2,66 |
Contudo, a presença de mais halogênios não garante que a cadeia torne-se mais polar. Pelo contrário, a depender da geometria molecular, os compostos podem ser, inclusive, apolares, como é o caso da 2,3,7,8-tetraclorodibenzeno-para-dioxina, um poluente organoclorado altamente tóxico:
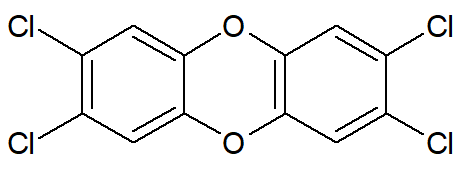
Com isso, podemos afirmar que existem haletos orgânicos tanto de caráter polar quanto de caráter apolar.
-
Pontos de fusão e ebulição
Os pontos de fusão e ebulição dependem sempre de dois fatores:
-
tamanho da cadeia carbônica
-
natureza de interação das moléculas
Quanto maior for a cadeia carbônica, mais intensas serão as interações intermoleculares, independentemente da sua natureza. Duas coisas interferem no tamanho de um haleto orgânico: a quantidade de carbonos na cadeia, obviamente, e o halogênio presente na estrutura.
O tamanho (raio atômico) dos halogênios cresce quanto maior for seu período na Tabela Periódica; logo, entre flúor, cloro, bromo e iodo, o flúor é o de menor tamanho (pois está no 2º período da Tabela), enquanto o iodo é o de maior tamanho (pois está no 5º período da Tabela). Por isso, haletos de alquila como o iodo sempre terão ponto de ebulição maior em comparação aos demais, como mostra a tabela abaixo:
|
Número de carbonos na cadeia principal |
Ponto de ebulição para o mono-haleto de alquila (ºC) |
|||
|
0 |
0 |
0 |
0 |
|
|
1 |
-78,4 |
-23,8 |
3,6 |
42,5 |
|
2 |
-37,7 |
13,1 |
38,4 |
72 |
|
3 |
-2,5 |
46,6 |
70,8 |
102 |
Já quando o tamanho é semelhante, devemos observar a natureza das interações intermoleculares. Haletos orgânicos polares fazem interações do tipo dipolo-dipolo, enquanto haletos orgânicos apolares fazem interações do tipo dipolo induzido-dipolo induzido, que é uma interação mais fraca.
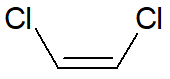
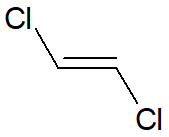
Veja o caso do trans-1,2-dicloro-eteno e do cis-1,2-dicloro-eteno. Ambos possuem a mesma massa molar, mas o isômero trans é apolar, enquanto o isômero cis é polar. Sendo assim, o primeiro realiza interações do tipo dipolo induzido-dipolo induzido, enquanto o segundo realiza interações do tipo dipolo-dipolo, e, por isso, o isômero cis possui maior ponto de ebulição.
|
Nome |
cis-1,2-dicloro-eteno |
trans-1,2-dicloro-eteno |
|
Estrutura |
|
|
|
Natureza quanto à polaridade |
Polar |
Apolar |
|
Ponto de ebulição (°C) |
60 |
48 |
-
Solubilidade em água
Associamos a solubilidade à regra do semelhante: compostos polares são solúveis em compostos polares, enquanto compostos apolares são solúveis em compostos apolares. Vale sempre lembrar, a água é um solvente polar.
Apesar de existirem haletos orgânicos polares, as moléculas dessa função orgânica possuem uma baixa solubilidade em água. Isso por conta de dois motivos: primeiro porque quanto maior se torna a cadeia carbônica, menos polar o haleto orgânico se torna; e segundo porque os halogênios não conseguem realizar ligações de hidrogênio com as moléculas de água, o que não favorece uma boa solubilidade em água.
Veja também: Densidade das soluções - somatório das massas do soluto e solvente com o volume da solução
Aplicações dos haletos orgânicos
Os haletos orgânicos estão associados principalmente aos pesticidas. São vários compostos comumente chamados de organoclorados, justamente pelo fato de serem orgânicos e terem boa presença de átomos de cloro.
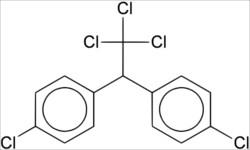
O mais famoso deles é o DDT, sigla de diclorodifeniltricloroetano, utilizado no combate ao mosquito do gênero Anopheles, transmissor da malária. A abreviação DDT, inclusive, gerou a palavra dedetização, que hoje associamos à aplicação de inseticidas e pesticidas em lavouras, residências ou demais espaços. A estrutura do DDT é a que se segue.
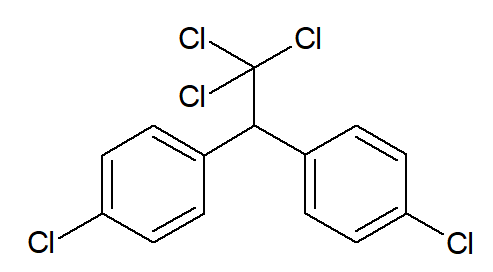
Entretanto, hoje o DDT é associado ao grande risco que pode causar à saúde humana, como desregulações hormonais, problemas ao sistema nervoso e, inclusive, desenvolvimento de câncer. Não à toa foi banido de vários países na década de 1970, e, atualmente, seu uso é controlado pela Convenção de Estocolmo sobre Poluentes Orgânicos Persistentes.
Na indústria, haletos orgânicos de baixa massa molecular são empregados como solventes, principalmente os clorados, pois são mais baratos que os brometos ou iodetos, por exemplo. Policlorometanos (como CCl4, CH2Cl2, CHCl3) são exemplos de solventes clorados utilizados na indústria.
O CCl4, cujo nome comercial é clorofórmio, já foi utilizado na lavagem a seco de roupas e também como anestésico local. Relata-se, inclusive, que a rainha Victoria da Inglaterra (1819-1901) se utilizou da técnica no parto de seus dois filhos caçulas, Leopoldo e Beatriz, popularizando-a no começo do século XX em países de língua inglesa e alemã (terra natal do seu marido, Albert). Posteriormente, a anestesia com clorofórmio teve que deixar de ser utilizada, uma vez que a substância é considerada tóxica para os seres humanos.

Haletos orgânicos também são muito utilizados como fluidos de refrigeração e em aerossóis, conhecidos comercialmente como Freon ou CFC (sigla para clorofluorcarbono). Entretanto, seu uso generalizado recebe críticas, uma vez que tais compostos são capazes de destruir a camada de ozônio. De forma geral, quando um CFC se decompõe por ação da luz, ele gera radicais livres de cloro e flúor, os quais são capazes de consumir o ozônio:
Primeira etapa: CF2Cl2 + luz → CF2Cl + Cl●
Segunda etapa: Cl● + O3 → ClO● + O2
Terceira etapa: ClO● + O → Cl● + O2
Como é possível perceber, o radical livre de cloro (Cl●) nunca é consumido, sendo sempre regenerado, podendo então destruir diversas moléculas de ozônio antes de sofrer outras reações na atmosfera.
[Nota: Fazer a tradução dos seguintes termos, se for possível, ou produzir imagem semelhante: Sun = Sol; Ultraviolet radiation: Radiação ultravioleta; Earth = Terra; The ozone layer absorbs alot of suns’s ultraviolet radiation = A camada de ozônio absorve a maioria da radiação ultravioleta do Sol.]
Confira nosso podcast: A química dos agrotóxicos
Videoaula sobre as funções orgânicas no Enem
Exercícios resolvidos sobre haletos orgânicos
Questão 1 - (Enem 2015) Pesticidas são substâncias utilizadas para promover o controle de pragas. No entanto, após sua aplicação em ambientes abertos, alguns pesticidas organoclorados são arrastados pela água até lagos e rios e, ao passar pelas guelras dos peixes, podem difundir-se para seus tecidos lipídicos e lá se acumularem.
A característica desses compostos, responsável pelo processo descrito no texto, é o(a)
A) baixa polaridade.
B) baixa massa molecular.
C) ocorrência de halogênios.
D) tamanho pequeno das moléculas.
E) presença de hidroxilas nas cadeias.
Resolução
Alternativa A
A questão faz referência a uma problemática: os pesticidas organoclorados são arrastados pela água até lagos e rios, e podem se acumular em tecidos lipídicos (gordurosos) de peixes ao passarem por suas guelras.
Para que um composto possa se difundir e acumular em um tecido lipídico, ele deve ter afinidade com tal tecido, o que quer dizer que precisa ter polaridade semelhante, ou seja, como se estivesse se solubilizando naquela região.
Os lipídios são conhecidos por serem compostos de baixa polaridade, pois são formados por longas cadeias de hidrocarbonetos. Sendo assim, a característica que permite os organoclorados se acumularem será justamente a sua baixa polaridade, que está descrita na letra A.
Nenhuma outra característica justifica tal comportamento.
Questão 2 - (Enem 2014) A liberação de gases clorofluorcarbonos (CFCs) na atmosfera pode provocar depleção de ozônio (O3) na estratosfera. O ozônio estratosférico é responsável por absorver parte da radiação ultravioleta emitida pelo Sol, a qual é nociva aos seres vivos. Esse processo, na camada de ozônio, é ilustrado simplificadamente na figura.
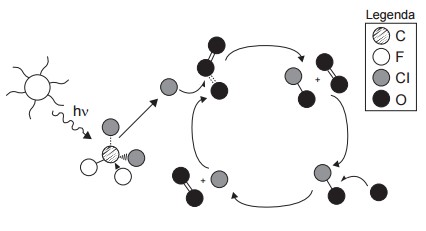
Quimicamente, a destruição da camada de ozônio na atmosfera por gases CFC é decorrência da:
A) clivagem da molécula de ozônio pelos CFC para produzir espécies radicalares.
B) produção de oxigênio molecular a partir do ozônio, catalisada por átomos de cloro.
C) oxidação do monóxido de cloro por átomos de oxigênio para produzir átomos de cloro.
D) reação direta entre os CFC e o ozônio para produzir oxigênio molecular e monóxido de cloro.
E) reação de substituição de um dos átomos de oxigênio na molécula de ozônio por átomos de cloro.
Resolução
Alternativa B
Nessa questão do Enem, devemos ter atenção ao enunciado, que pede para sabermos o que leva à destruição da camada de ozônio por gases CFC.
Ao observar a imagem da questão, percebemos que as esferas mais escuras, de cor preta, representam o átomo de oxigênio, enquanto as esferas cinzas representam o cloro.
A destruição da camada de ozônio é, na verdade, a clivagem/quebra da molécula O3. Ao olhar o esquema, percebemos que quem ataca a molécula de O3 e realiza sua quebra é justamente um átomo de cloro na forma de radical livre Cl●.
Assim podemos eliminar a letra A e a letra D, por exemplo, pois o ozônio não é clivado pelo CFC diretamente. Também não se percebe a substituição de um oxigênio pelo cloro, mas sim uma decomposição, e, por isso, a letra E também deve ser descartada. A letra C fala de uma etapa que de fato ocorre, mas apenas após a quebra da molécula de ozônio e não como a causa para a quebra. A oxidação do monóxido de cloro pelo átomo de oxigênio é, na verdade, o que regenera os átomos de cloro que atacam diretamente a molécula de ozônio.
Sendo assim, a resposta correta é a de letra B, pois podemos perceber que é o próprio átomo de cloro quem faz a quebra do O3. Dizemos que ele é o catalisador, pois não é consumido, ou seja, é regenerado ao longo do processo.
Por Stéfano Araújo Novais
Professor de Química




.jpg)