Conforme explanado no texto “Tipos de Forças Intermoleculares”, as moléculas das substâncias nos três estados físicos (sólido, líquido e gasoso) se atraem por meio de uma das forças intermoleculares.
As três forças intermoleculares conhecidas são: dipolo induzido – dipolo induzido, dipolo permanente – dipolo permanente e ligação de hidrogênio. Entre elas, a ligação de hidrogênio é a mais forte. Alguns autores costumavam se referir a essa força intermolecular como pontes de hidrogênio; porém, o termo correto e aceito pela IUPAC é “ligação de hidrogênio”.
Esse tipo de interação ocorre quando a molécula possui hidrogênio ligado a flúor, nitrogênio ou oxigênio, que são átomos fortemente eletronegativos.
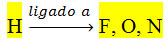
A ligação de hidrogênio é um exemplo extremo da ligação dipolo permanente-dipolo permanente. Pois o hidrogênio de uma molécula constitui um polo positivo, que se liga a um desses átomos de flúor, oxigênio ou nitrogênio de outra molécula, que constituem o polo negativo delas.
Normalmente, as ligações intermoleculares ocorrem com as substâncias nos estados líquido e sólido. Além disso, visto que é uma força de atração muito intensa, é necessária uma energia bem alta para rompê-la.
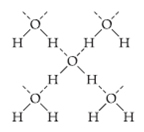
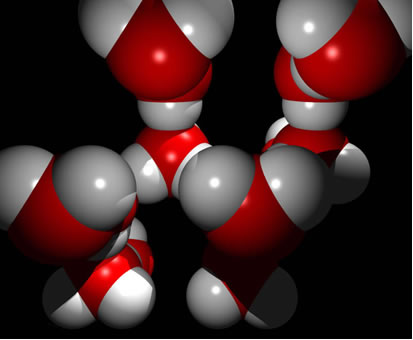
Uma substância que apresenta essa força intermolecular é a própria água. Observe como isso ocorre na ilustração abaixo:
.jpg)
Observe que cada molécula de água fica circundada espacialmente por outras quatro moléculas de água, sendo que as ligações de hidrogênio ocorrem pela ligação entre o hidrogênio de uma molécula (polo positivo) com o oxigênio de outra (polo negativo).
As ligações de hidrogênio explicam vários fenômenos da natureza, veja os seguintes exemplos:
- O fato de o gelo flutuar na água: O gelo é menos denso do que a água e, consequentemente, flutua nela. Isso ocorre porque enquanto no estado líquido as ligações de hidrogênio que ocorrem entre as moléculas de água estão dispostas numa forma desorganizada, as ligações de hidrogênio nas moléculas do gelo são mais espaçadas e organizadas, formando uma estrutura rígida de forma hexagonal, que faz as moléculas ocupar um espaço bem maior do que ocupariam se estivessem no estado líquido.
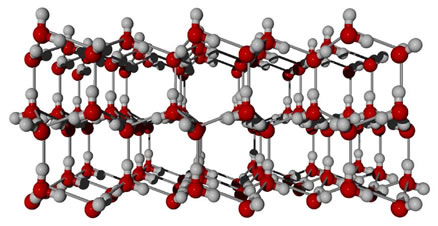
É inclusive por isso que se colocarmos água no volume total de uma garrafa e a colocarmos posteriormente em um refrigerador, seu volume se expandirá e a garrafa irá rachar.
Assim, haverá a mesma quantidade de moléculas por unidade de volume, o que diminui a densidade, segundo a fórmula da densidade: d = m/v. Haverá espaços vazios entre os hexágonos formados, diminuindo a densidade dessa substância.
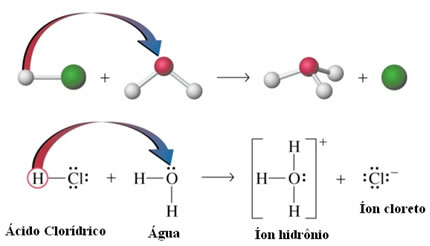
- Ionização dos ácidos: Apesar de as ligações de hidrogênio serem aproximadamente dez vezes mais fracas que as ligações covalentes; em determinadas circunstâncias elas conseguem romper as ligações covalentes. Por exemplo, no caso mostrado a seguir, o ácido clorídrico é dissolvido em água. O oxigênio da água atrai mais o hidrogênio ligado ao cloro do ácido do que o próprio cloro, dando origem aos íons hidrônio (H3O+) e cloreto (Cl-). Esse fenômeno é denominado de ionização:
- Tensão superficial da água: as moléculas que estão na superfície do líquido se atraem pelas ligações de hidrogênio somente com as moléculas ao seu lado e abaixo, pois não existem moléculas acima. Já as moléculas que estão abaixo da superfície realizam esse tipo de ligação com moléculas em todas as direções, o resultado é a formação de uma espécie de película ou fina camada na superfície da água, que a envolve.
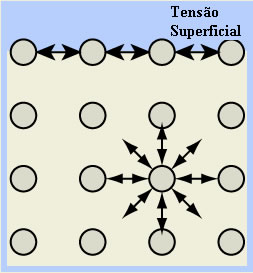
Isso explica o fato de insetos poderem permanecer sobre ela e também o fenômeno da forma esférica das gotas de água.

Por Jennifer Fogaça
Graduada em Química



.jpg)