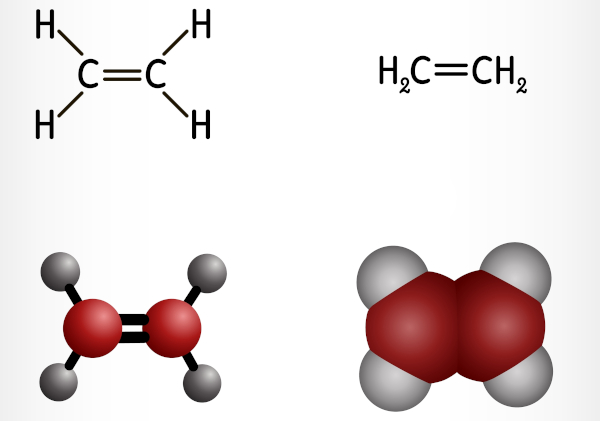
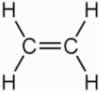
Os alcenos são hidrocarbonetos de cadeia aberta, de cadeia ramificada ou não, que possuem uma ligação dupla entre carbonos. Possuem fórmula geral CnH2n e ainda podem ser chamados de olefinas. Destacam-se pelo baixíssimo caráter polar, bem como uma maior reatividade em comparação aos alcanos, por conta da presença dos elétrons π.
Leia também: Benzeno — um hidrocarboneto aromático
Tópicos deste artigo
- 1 - Resumo sobre alcenos
- 2 - O que são alcenos?
- 3 - Propriedades e características dos alcenos
- 4 - Nomenclatura dos alcenos
- 5 - Aplicação dos alcenos
- 6 - Obtenção dos alcenos
- 7 - Exercícios resolvidos sobre alcenos
Resumo sobre alcenos
-
Os alcenos são hidrocarbonetos de cadeia aberta, ramificados ou não, que possuem a presença de uma ligação dupla entre carbonos.
-
Têm propriedades semelhantes às dos alcanos, porém possuem um caráter polar um pouco maior, além de serem mais reativos quimicamente.
-
Em termos de nomenclatura, por serem hidrocarbonetos, possuem o mesmo sufixo da classe, mas com a variação no infixo para indicar a ligação dupla.
-
Destacam-se os alcenos eteno e propeno, por conta da alta demanda para a produção dos polímeros polietileno e polipropileno.
-
O eteno é também utilizado no processo de maturação de frutas.
Não pare agora... Tem mais depois da publicidade ;) -
Para a síntese de alcenos, as reações mais comuns são de eliminação: desidroalogenação de haletos de alquila e desidratação alcoólica.
O que são alcenos?
Os alcenos são hidrocarbonetos de cadeia aberta (acíclica) que possuem uma ligação dupla entre carbonos. Essa cadeia aberta pode ser ramificada ou não. Possuem fórmula geral CnH2n e também podem ser chamados de olefinas.
A seguir, alguns exemplos de alcenos:

Importante: A Iupac recomenda que os hidrocarbonetos acíclicos, de cadeia ramificada ou não, com duas ligações duplas devam ser chamados de alcadienos; com três, alcatrienos; e assim sucessivamente.
Propriedades e características dos alcenos
Em termos de propriedades físicas, os alcenos têm propriedades semelhantes às dos alcanos com até quatro carbonos de modo que são gases à temperatura ambiente. As temperaturas de fusão e ebulição vão aumentando conforme a cadeia do alceno também aumenta, pois assim as interações vão se tornando mais intensas.
Os alcenos possuem também dois carbonos de hibridização sp2 (os que fazem uma ligação dupla, π). Esses carbonos são um pouco mais eletronegativos que os carbonos sp3 (os que fazem apenas ligações simples), e, por conta disso, os alcenos são ligeiramente mais solúveis que alcanos em água. Todavia, o caráter polar dos alcenos não é significativo em comparação ao caráter apolar dessas substâncias. Por isso, a solubilidade dos alcenos é mais adequada em solventes apolares.
Em termos de reatividade, os alcenos são mais reativos que os alcanos, por conta da presença da ligação π, a qual é mais fraca que as ligações σ. Contudo, experimentalmente, percebe-se que quanto mais cadeias alquílicas estiverem ligadas aos carbonos da ligação dupla, maior a estabilidade do alceno — lembrando que cadeias alquílicas estão relacionadas a radicais derivados de alcanos, como metil, etil, propil etc. Essa maior estabilidade é mostrada na imagem a seguir.
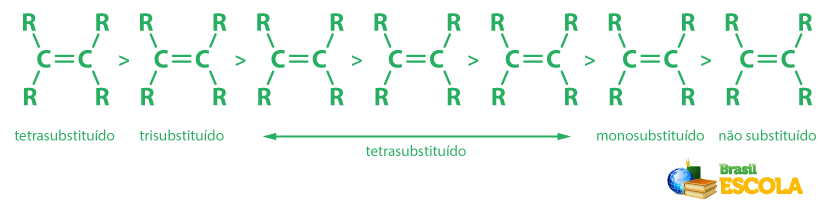
Saiba mais: Alcinos — os hidrocarbonetos que possuem tripla ligação entre átomos de carbono
Nomenclatura dos alcenos
Segundo a Iupac, todos os hidrocarbonetos devem possuir o sufixo –o. Os alcenos, contudo, possuem a excepcionalidade da ligação dupla. As regras de nomenclatura sistemática indicam que as insaturações são representadas pelo infixo, e, para ligações duplas, o infixo utilizado é –en–.
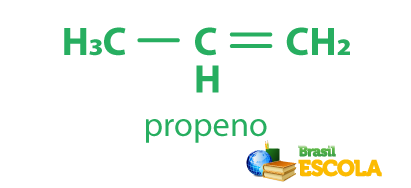
No caso do propeno, temos:
-
prop–: prefixo para indicar que existem três carbonos na cadeia.
-
–en–: infixo para indicar a presença da ligação dupla.
Não pare agora... Tem mais depois da publicidade ;) -
–o: sufixo de hidrocarboneto.
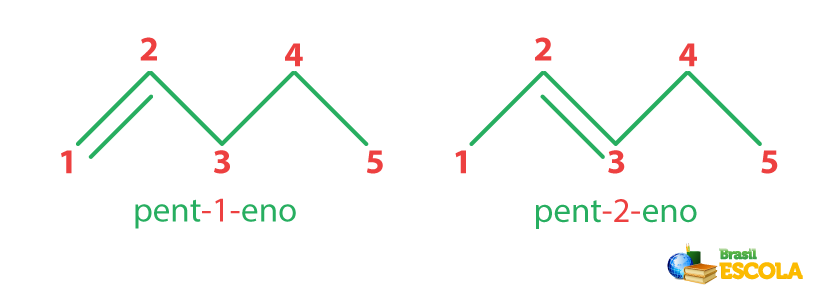
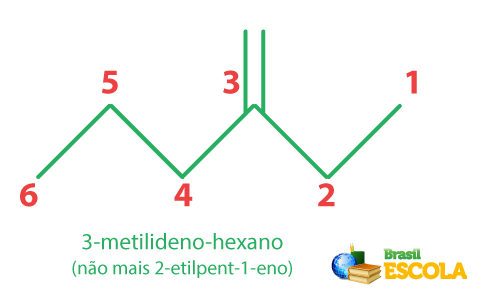
Como a ligação dupla pode, por meio de alcenos de quatro carbonos, ter mais de uma posição possível na cadeia principal, deve-se utilizar o número do carbono da ligação dupla inicial no nome oficial para indicar a posição da insaturação.
No caso de uma cadeia ramificada, a insaturação possui prioridade sobre a ramificação e, por isso, a contagem da cadeia principal deve se iniciar pelo carbono da extremidade mais próxima da ligação dupla:
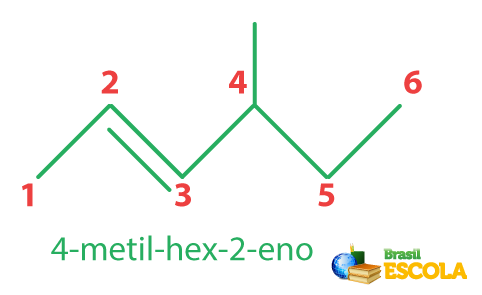
Anteriormente, a Iupac recomendava que a insaturação deveria ficar na cadeia principal, mesmo que a cadeia com a ligação dupla não fosse a maior possível. Porém, isso mudou, e, a partir de agora, a maior cadeia sempre será a principal, tendo insaturação ou não.
Aplicação dos alcenos
Dos alcenos existentes, os de maior aplicação industrial são o eteno e o propeno. Isso porque eles são as matérias-primas para os dois polímeros mais produzidos no mundo: o polietileno (PE) e o polipropileno (PP).
Enquanto o propeno apresenta uma produção média de 133 milhões de toneladas métricas por ano, o eteno apresenta uma produção média de 200 milhões de toneladas métricas anuais, sendo que nenhum outro produto orgânico possui um índice de produção tão alto.

O PE e o PP estão entre os tipos de plástico mais utilizados por nós. Do PE se produzem dois tipos: o de baixa densidade (PEBD) e o de alta densidade (PEAD). Do PEAD são produzidos os frascos de diversos produtos, como de detergentes, óleos automotivos, produtos de limpeza, além de tampas e sacolas de supermercado. Já do PEBD são confeccionadas sacolas de supermercado, sacos de lixo e também o plástico filme para embalar nossos alimentos.

Já do polipropileno são feitos canudos, carpetes, peças automotivas, seringas descartáveis e também caixas de bebidas.

Além disso, o eteno é encontrado na natureza como hormônio vegetal e está envolvido no processo de maturação de frutos, como bananas e tomates. Industrialmente, pode-se utilizar o eteno para forçar o amadurecimento de frutos que foram colhidos verdes, já que nessa condição os frutos são menos suscetíveis a danos quando transportados.
Outra importante função do eteno é como precursor químico. Dele é possível produzir o etanol, o óxido de etileno (um esterilizante) e o etanal, por exemplo.
Obtenção dos alcenos
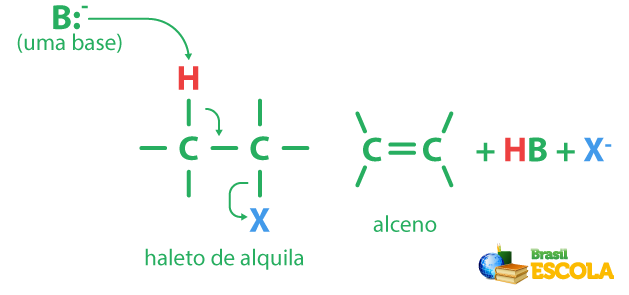
A principal forma de obtenção de alcenos se dá por meio de reações de eliminação, destacando-se a desidroalogenação de haletos de alquila e a desidratação de álcoois.
Na desidroalogenação de haletos de alquila, a reação geral é a seguinte (figura abaixo). Ela segue o mecanismo de eliminação E2, e uma base forte (como um íon alcóxido) é utilizada. Utiliza-se “X” para designar o halogênio.
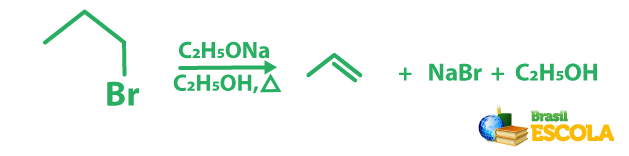
Um exemplo dessa reação é a que se segue:
Já para a desidratação de álcoois, deve-se utilizar um ácido inorgânico, como ácido sulfúrico ou ácido fosfórico, em condições que dependerão da facilidade de desidratação do álcool. Quanto mais fácil for a desidratação, mais amenas serão as condições reacionais. Em geral, a ordem decrescente de facilidade de desidratação é:
álcool terciário > álcool secundário > álcool primário
A reação geral de desidratação é a que se segue. HA é uma forma genérica de representar o ácido.
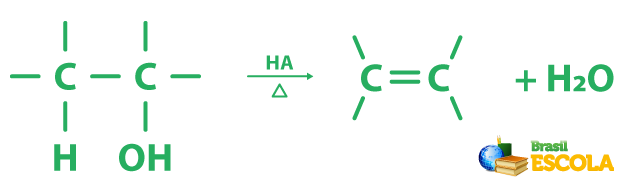
O etanol, por exemplo, é de difícil desidratação. Então exige a utilização de ácido sulfúrico concentrado e uma alta temperatura (180 °C).

Veja também: Ácidos carboxílicos — compostos orgânicos caracterizados pela presença de uma carboxila
Exercícios resolvidos sobre alcenos
Questão 1
(UFU-MG) A substância de fórmula C8H16 representa um:
A) alcano de cadeia aberta.
B) alceno de cadeia aberta.
C) alcino de cadeia aberta.
D) composto aromático.
E) alcino de cadeia fechada.
Resolução:
Alternativa B
Ao se avaliar a fórmula molecular, percebe-se que a substância é do tipo CnH2n, que só pode indicar duas classes de hidrocarbonetos: cicloalcanos ou alcenos. Na ausência de cicloalcano, a resposta só pode ser um alceno de cadeia aberta.
Questão 2
(ITA-SP) Embrulhar frutas verdes em papel jornal favorece o seu processo de amadurecimento devido ao acúmulo de um composto gasoso produzido pelas frutas. Assinale a opção que indica o composto responsável por esse fenômeno.
A) Eteno.
B) Metano.
C) Dióxido de carbono.
D) Monóxido de carbono.
E) Amônia.
Resolução:
Alternativa A
O processo de maturação de frutas está ligado ao menor alceno existente, um gás de fórmula C2H4, cujo nome oficial é eteno.
Por Stéfano Araújo Novais
Professor de Química