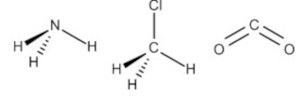
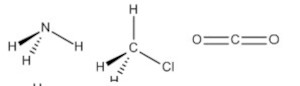
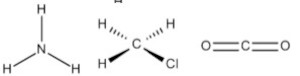
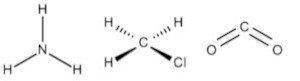
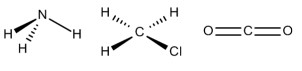
A geometria molecular é uma forma de representar o arranjo especial adotado pelos átomos de uma molécula. Apesar de a geometria de uma molécula não ser prevista pelas estruturas de Lewis, ela é obtida por meio delas. A teoria utilizada para determinar a geometria das moléculas se chama teoria da repulsão do par de elétrons da camada de valência, RPECV.
A geometria molecular de uma molécula é a sua forma espacial mais estável, pois, segundo a RPECV, os elétrons, tanto ligantes quanto não ligantes, exercem repulsão eletrônica, buscando ficar o mais distante possível. O estudo da geometria molecular é importante não só para o campo teórico da Química, mas também para aplicações, como em biotecnologia.
Leia também: Como funciona a teoria do octeto?
Tópicos deste artigo
- 1 - Resumo sobre geometria molecular
- 2 - Videoaula sobre geometria molecular
- 3 - O que é geometria molecular?
- 4 - Tipos de geometria molecular
- 5 - Como determinar a geometria da molécula?
- 6 - Importância da geometria molecular
- 7 - Exercícios resolvidos sobre geometria molecular
Resumo sobre geometria molecular
- A geometria molecular serve para demonstrar o arranjo espacial dos átomos em uma molécula.
- A geometria de uma molécula é obtida por meio da sua estrutura de Lewis.
- Utiliza-se a teoria da repulsão do par de elétrons da camada de valência, RPECV, para determinar uma geometria molecular.
- A RPECV parte do pressuposto que os elétrons ligantes e não ligantes se repelem, originando uma geometria de maior estabilidade.
- A geometria molecular é importante para campos teóricos, como a determinação de polaridade e entendimento da reatividade, assim como para campos práticos, como atividade biológica de moléculas.
Videoaula sobre geometria molecular
O que é geometria molecular?
A geometria molecular é uma forma de representação utilizada para demonstrar o arranjo espacial dos átomos presentes em moléculas. Esse arranjo especial não é previsto pela teoria de ligação de Lewis e é importante para demonstrar, didaticamente, como as moléculas fazem para minimizar os efeitos repulsivos das ligações covalentes.
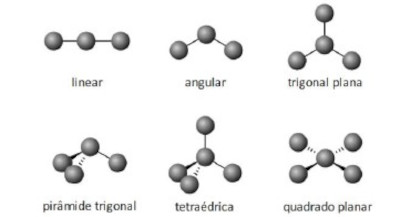
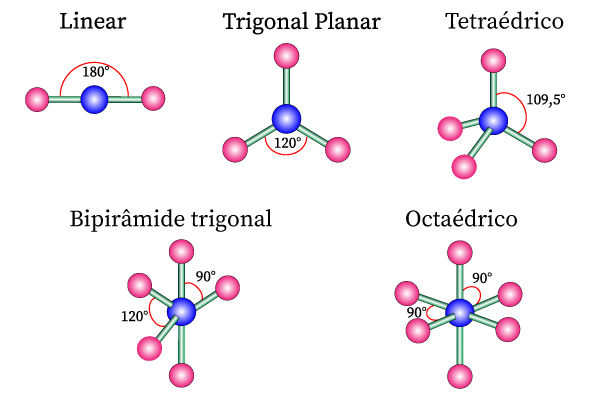
Tipos de geometria molecular
As geometrias das moléculas são oriundas dos arranjos espaciais das moléculas. Tal arranjo é dependente dos pares de elétrons do átomo central, sejam esses pares ligantes ou não. Por meio do número de pares de elétrons e não ligantes, determina-se a geometria molecular. A tabela a seguir lista os tipos de geometria possíveis para cada molécula, de acordo com seus arranjos e pares de elétrons.
|
Pares de elétrons (ligantes + não ligantes) |
Arranjo espacial |
Geometrias possíveis |
|
2 |
Linear |
Linear |
|
3 |
Trigonal plano |
Linear |
|
Trigonal plana |
||
|
4 |
Tetraédrico |
Linear |
|
Angular |
||
|
Trigonal plana |
||
|
5 |
Bipirâmide trigonal |
Linear |
|
Forma de T |
||
|
Gangorra |
||
|
Bipirâmide trigonal |
||
|
6 |
Octaédrico |
Quadrado planar |
|
Pirâmide quadrada |
||
|
Octaédrica |
||
|
7 |
Bipirâmide pentagonal |
Bipirâmide pentagonal |
Como determinar a geometria da molécula?
A melhor forma de determinar a geometria de uma molécula é pela teoria da repulsão do par de elétrons da camada de valência, a RPECV (também comumente referida como VSEPR, do inglês valence-shell electron-pair repulsion model). Tal teoria foi inicialmente proposta a partir dos estudos de repulsão eletrostática dos pares de elétrons dos químicos ingleses Nevil Sidgwick e Herbert Powell, em 1940, e então desenvolvida pelo químico canadense Ronald Gillespie e pelo químico australiano Ronaldo Nyholm, em 1957.
Apesar de simples, sua previsibilidade para determinação da geometria das moléculas é muito boa, com favorável comparação aos resultados obtidos experimentalmente (difração de raios X, por exemplo). Essa teoria parte do pressuposto de que os elétrons se repelem, uma vez que possuem a mesma carga elétrica e, assim sendo, as moléculas adotam um arranjo espacial em que os pares de elétrons buscarão ficar o mais distante possível, minimizando os efeitos de repulsão elétron-elétron.
No RPECV, as moléculas podem ser descritas na forma genérica AXmEn, em que:
- “A” é o átomo central;
- “X” representa qualquer átomo ou grupo atômico ligado ao elemento central;
- “E” representa um par de elétron isolado (não ligante).
O somatório “m + n” é conhecido como número estéreo (NE), que acaba sendo o número total de posições ocupadas por ligantes ou pares de elétrons em torno do átomo central. A geometria resultante, segundo a RPECV, será consequência do arranjo adotado pelos pares de elétrons ligantes. Os pares de elétrons são importantes para determinar o arranjo espacial da molécula, e influenciam na forma espacial final da molécula, mas não são levados em conta para a determinação da geometria molecular final.
Outro ponto importante do RPECV é que as ligações múltiplas (duplas ou triplas) são tratadas como uma única região de alta concentração de elétrons, ou seja, não faz diferença para a geometria final se a ligação é simples ou múltipla.
Por fim, vale destacar ainda que o RPECV cria uma escala de repulsões eletrônicas, a fim de trazer maior aproximação com os valores obtidos experimentalmente. Assim sendo, os elétrons em pares isolados (pi), ou seja, não ligantes, apresentam uma repulsão mais forte que os elétrons em pares ligantes (pl). Assim, a escala decrescente de força de repulsão eletrônica é:
repulsão pi-pi > repulsão pi-pl > repulsão pl-pl
-
Número estéreo igual a 2
Vamos ver o caso do CO2, que é uma molécula cujo NE é igual a 2 (O=C=O, m = 2, n = 0). A maior distância entre as ligações é, obviamente, um ângulo de 180°. Por isso, a molécula de CO2 admite uma geometria linear.
-
Número estéreo igual a 3
Para moléculas de NE igual a 3, vamos avaliar o caso do BF3 (trifluoreto de boro), do O3 (gás ozônio) e do CO (monóxido de carbono). Para esse número estéreo, o arranjo espacial é tetraédrico, com as geometrias possíveis: trigonal plana (m = 3, n = 0), angular (m = 2, n = 1) e linear (m = 1, n = 2).
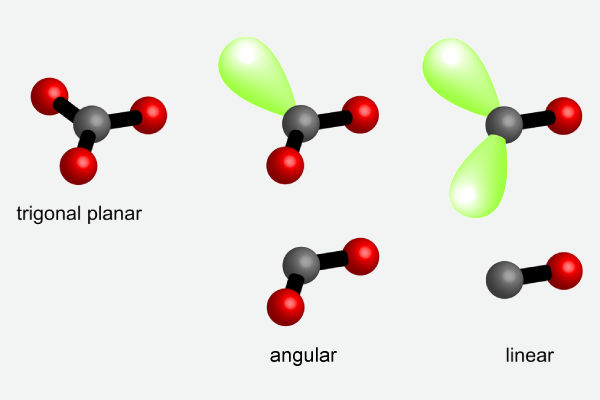
Vamos agora observar as moléculas citadas dentro do arranjo trigonal plano.
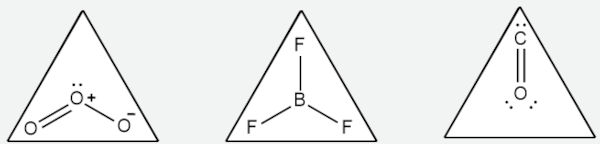
O trifluoreto de boro (BF3) é uma molécula de NE igual a 3, pois o átomo de boro apresenta três ligações com os três átomos de flúor, não restando elétrons não ligantes, conforme a imagem mostra a seguir (m = 3, n = 0). Assim sendo, a maior distância angular entre as ligações é de 120° e, assim, a geometria molecular coincide com o arranjo espacial: trigonal plana.
O ozônio, O3, também é um caso de molécula com número estéreo igual a 3, mas com a diferença de que possui duas ligações (m = 2) e um par de elétron isolado (n = 1). O par de elétron isolado (não ligante) não é levado em consideração para se dizer a geometria e, portanto, o O3 possui geometria linear. Como a repulsão pi-pl é mais forte que a repulsão pl-pl, o ângulo entre as ligações covalentes do ozônio acaba sendo menor que 120° (experimentalmente determinado como 117°).
Já para o monóxido de carbono, CO, o oxigênio e o carbono fazem uma ligação química múltipla e apenas a geometria linear é possível nesse arranjo, uma vez que desconsideramos os pares de elétrons isolados para determinação da geometria.
-
Número estéreo igual a 4
Para NE igual a 4, temos os exemplos das moléculas de metano (CH4), amônia (NH3), água (H2O) e cloreto de hidrogênio (HCl). Os parâmetros m e n são dispostos na tabela a seguir.
|
Moléculas de NE = 4 |
m (par ligante) |
n (par isolado) |
|
CH4 |
4 |
0 |
|
NH3 |
3 |
1 |
|
H2O |
2 |
2 |
|
HCl |
1 |
3 |
Dessa forma, as geometrias possíveis para o arranjo tetraédrico estão dispostas a seguir.
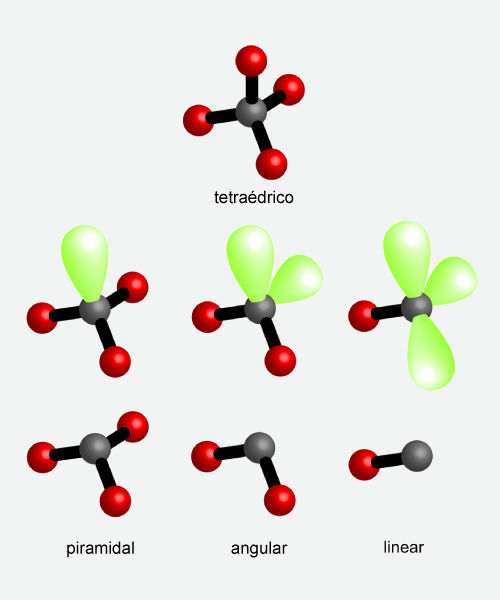
A imagem a seguir mostra o arranjo tetraédrico formado entre os pares de elétrons ligantes e pares de elétrons isolados.
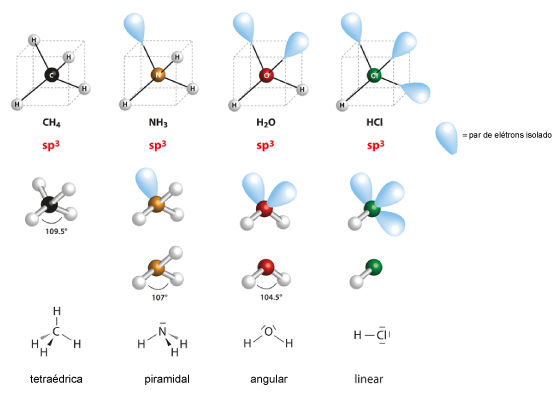
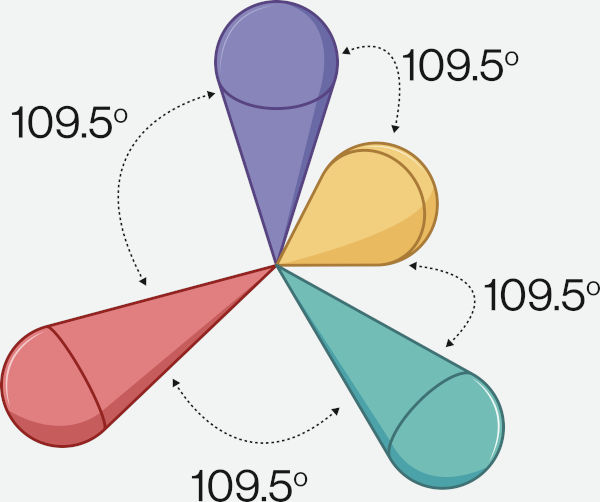
O CH4, que não possui pares de elétrons isolados, apresenta a maior distância angular possível entre elétrons ligantes (109,5°). Dessa forma, sem pares de elétrons isolados, a geometria é a mesma do arranjo espacial: tetraédrica.
Já a amônia possui um par de elétrons isolado, fazendo com que o ângulo entre os pares ligantes seja menor, ficando em 107°. Ao se ignorar o par de elétrons isolado para determinação da geometria, tem-se a geometria piramidal. A água, com dois pares de elétrons isolados, diminui ainda mais o ângulo dos pares de elétrons ligantes no arranjo tetraédrico, fazendo com que o ângulo da ligação seja 104,5 °. Nesse caso, com apenas dois pares ligantes, a água toma a geometria angular.
Para o cloreto de hidrogênio, HCl, só é possível que a geometria seja linear, uma vez que só há um par ligante.
-
Número estéreo igual a 5
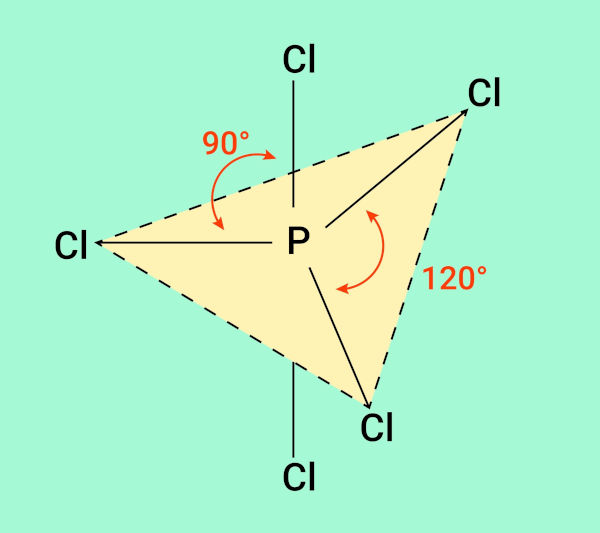
Quando NE é igual a 5, com arranjo bipiramidal trigonal, os pares isolados podem tomar duas posições: equatorial (quando estão no plano horizontal) ou axial (quando estão no eixo vertical). A distância angular entre pares de elétrons equatoriais é de 120°; já a distância angular entre um par de elétrons axial e outro equatorial é de 90°, conforme a imagem a seguir demonstra.
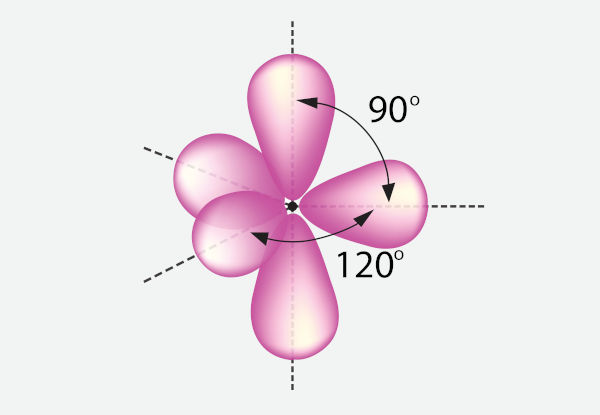
A depender do número de pares de elétrons ligantes e isolados, as geometrias possíveis são:
- bipirâmide trigonal (m = 5);
- gangorra (m = 4 e n = 1);
- forma de T (m = 3 e n = 2);
- linear (m = 2, n = 3).
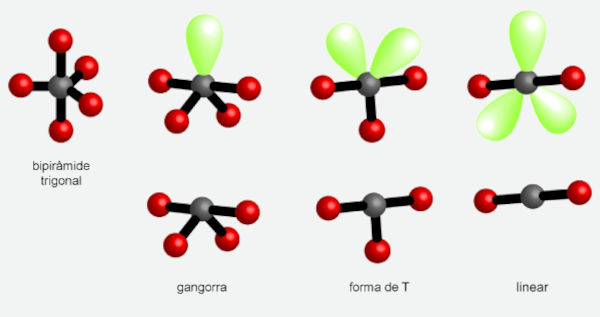
Uma molécula que possui apenas pares de elétrons ligantes (m = 5) nesse arranjo espacial é o PCl5 (pentacloreto de fósforo). Assim sendo, a geometria também é bipirâmide trigonal. A imagem a seguir demonstra como os átomos se orientam para formar a geometria mencionada.
A tabela a seguir traz outras moléculas com arranjo bipirâmide trigonal, mas agora com outras geometrias, por conta da presença de pares de elétrons isolados.
|
Molécula |
Geometria |
m |
n |
Estrutura |
|
SF4 |
Gangorra |
4 |
1 |
|
|
ClF3 |
Forma de T |
3 |
2 |
|
|
I3− |
Linear |
2 |
3 |
|
No caso, na geometria gangorra, o par isolado, para apresentar maior distância angular possível de todos os pares ligantes, fica na posição equatorial. Isso acaba gerando uma leve repulsão nos pares ligantes axiais, que deixam de estar colineares.
Algo semelhante ocorre na geometria em forma de T, pois os pares de elétrons isolados se posicionam também no plano equatorial, a fim de se obter a maior distância angular entre os pares de elétrons.
Já na geometria linear os três pares isolados ficam no plano axial, criando uma distância angular maior entre os pares de elétrons ligantes (180°).
-
Número estéreo igual a 6
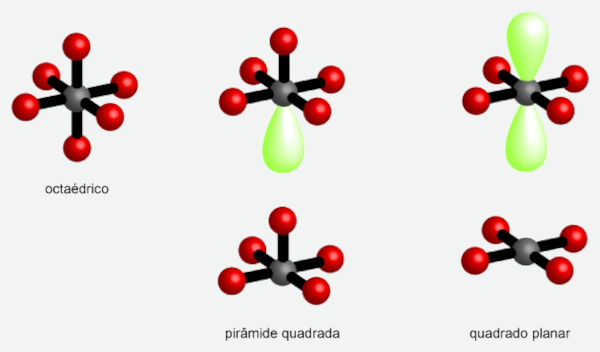
O arranjo espacial octaédrico é o que ocorre para número estéreo igual a 6. As geometrias possíveis estão dispostas a seguir.
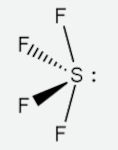
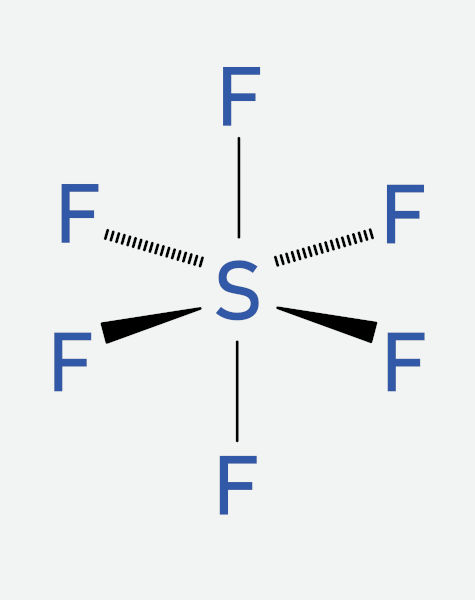
A molécula SF6 (hexafluoreto de enxofre) é um exemplo de molécula octaédrica com m = 6 e n = 0 (apenas pares de elétrons ligantes). Nesse caso, a geometria é igual ao arranjo espacial: octaédrica.
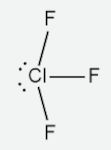
As demais geometrias para o arranjo octaédrico podem ser observadas nas moléculas de IF5 (pentafluoreto de iodo, geometria pirâmide quadrada) e XeF4 (tetrafluoreto de enxofre, geometria quadrado planar). O IF5 possui um par de elétrons isolado, enquanto o XeF4 possui dois pares de elétrons isolados.

Importância da geometria molecular
A importância da geometria molecular transcende a Química puramente teórica. Graças à geometria molecular é possível determinar a polaridade das moléculas, aspecto fundamental para entender parâmetros como solubilidade em solventes e interações intermoleculares, o que desencadeia na compreensão dos pontos de fusão e ebulição das estruturas.
A geometria também influencia na reatividade das moléculas. A depender da geometria, um sítio reativo da molécula pode ficar mais ou menos exposto, facilitando o ataque de nucleófilos ou eletrófilos. A geometria também é importante para atividades biológicas.
Em um medicamento, por exemplo, a molécula do princípio ativo precisa se ligar a um sítio ativo específico para desenvolver seu efeito. Essa ligação, que pode ser a uma proteína, só ocorrerá por causa de um encaixe específico, consequência de sua forma determinada a partir da geometria molecular. Outro exemplo são as enzimas, as quais são estereosseletivas, ou seja, são capazes de se ligar apenas com moléculas específicas, a partir de reconhecimento de seu arranjo espacial.
O monóxido de carbono, CO, é um caso trágico da geometrtia molecular. Por ter tamanho semelhante e mesma geometria do gás oxigênio, O2, o CO pode se ligar à hemoglobina do sangue, através do íon Fe2+, desencadeando um caso de hipóxia (não recepção de oxigênio por parte dos órgãos e tecidos), o que pode levar até mesmo à morte.
Saiba mais: Distribuição eletrônica — como é feita a representação dos elétrons nas camadas eletrônicas
Exercícios resolvidos sobre geometria molecular
Questão 1. (FCMSCSP - Santa Casa Medicina/2023) Resíduos de alimentos podem ser transformados em fonte de energia por meio de fermentação anaeróbia em biodigestores. Nesse processo ocorre a formação de uma mistura de gases rica em metano (CH4) que contém também vapor de água (H2O), amônia (NH3), sulfeto de hidrogênio (H2S) e dióxido de carbono (CO2).
Dentre as moléculas gasosas formadas nesse processo, aquela que apresenta ângulo de ligação de 180º é a de
- água.
- dióxido de carbono.
- sulfeto de hidrogênio.
- metano.
- amônia.
Resposta: Letra B.
Para ter ângulo de ligação de 180°, a molécula precisa apresentar geometria linear. Para determinar a geometria, analisemos as estruturas de Lewis de cada composto:
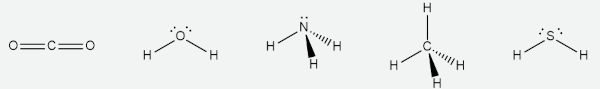
Observa-se, pelas estruturas, que, à exceção do CO2, os demais compostos possuem, segundo a teoria RPECV, número estéreo igual a 4 (somatório de pares ligantes e isolados). Com esse número estéreo, a única forma de se obter geometria linear seria se a molécula possuísse um único par ligante e três pares isolados, o que não ocorre em nenhum caso. O CO2 possui número estéreo igual a 2, sendo dois pares ligantes. Assim sendo, a sua geometria é linear (a única possível para esse número estéreo).
Questão 2. (UEMG/2022) Assinale a alternativa que apresenta corretamente a geometria molecular dos compostos tetrafluoreto de silício, pentacloreto de fósforo, hidreto de fósforo e íon nitrito, respectivamente.
- Tetraédrica, piramidal quadrada, trigonal planar e forma de “T”.
- Tetraédrica, bipirâmide trigonal, pirâmide trigonal e angular.
- Pirâmide trigonal, bipiramidal trigonal, pirâmide trigonal e trigonal planar.
- Tetraédrica, bipiramidal trigonal, trigonal planar e angular.
Resposta: Letra B.
A determinação da geometria molecular segue a teoria RPECV. Para tal, devemos determinar os números estéreos por meio das estruturas. Vejamos:
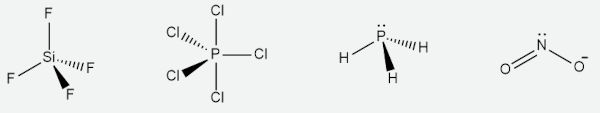
O tetrafluoreto de silício (SiF4) e o hidreto de fósforo (PH3) possuem número estéreo igual a 4 (somatório de pares ligantes e isolados). No caso, o SiF4 possui quatro pares ligantes e, assim sendo, possui geometria tetraédrica. Já o PH3, com um par isolado e três pares ligantes, admite geometria piramidal.
O pentacloreto de fósfoto (PCl5) possui número estéreo igual a 5 e, assim, com quatro pares ligantes, admite geometria bipiramidal trigonal. Já o íon nitrito (NO2−) possui número estéreo igual a 3, com dois pares ligantes e um par isolado. Nessa configuração, então, terá geometria linear.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
HOUSECROFT, C. E.; SHARPE, A. G. Inorganic Chemistry. 4. ed. Harlow (Inglaterra): Pearson Education Limited, 2012.
JIANG, M.; YU, C.; XU, Z.; QIN, Z. Binding of Carbon Monoxide to Hemoglobin in an Oxygen Environment: Force Field Development for Molecular Dynamics. Journal of Chemical Theory and Computation. v. 20, n. 10, fev. 2024.
KORTAGERE, S.; KRASOWSKI, M. D.; EKINS, S. The Importance of Discerning Shape in Molecular Pharmacology. Trends in Pharmacological Sciences. 30(3), 138-147, mar. 2009.
MIESSLER, G. L.; FISCHER, P. J.; TARR, D. A. Química Inorgânica. 5. ed. São Paulo: Pearson Education do Brasil, 2014.