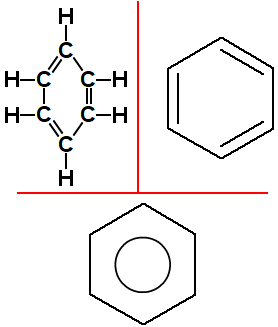
Hidrocarbonetos aromáticos são compostos orgânicos formados exclusivamente por átomos de carbono e hidrogênio. Apresentam obrigatoriamente uma estrutura básica (anel ou núcleo aromático) composta por:
- Cadeia fechada
- Seis átomos de carbono
Três ligações duplas (formada por uma ligação pi e uma sigma) alternadas
Versões diferentes da fórmula estrutural do benzeno
As ligações duplas alternadas presentes no benzeno sofrem um efeito de ressonância no qual as ligações pi (de cada uma dessas duplas) trocam de posição constantemente, o que é representado por um círculo no interior do hexágono (vide imagem acima).
Assim, temos que a estrutura básica de um hidrocarboneto aromático apresenta uma fórmula molecular igual a C6H6. A nomeclatura Iupac (oficial) dada a ela é benzeno.
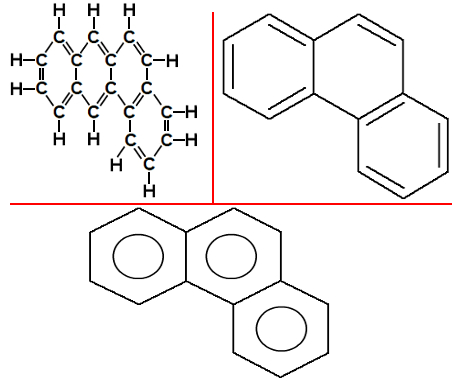
Além do benzeno, existem outros importantes hidrocarbonetos aromáticos, denominados condensados (quando a estrutura aromática está ligada diretamente à outra estrutura aromática):
Naftaleno: hidrocarboneto aromático composto por duas estruturas aromáticas que apresentam uma ligação dupla e dois átomos de carbono em comum. Sua fórmula molecular é C10H8.
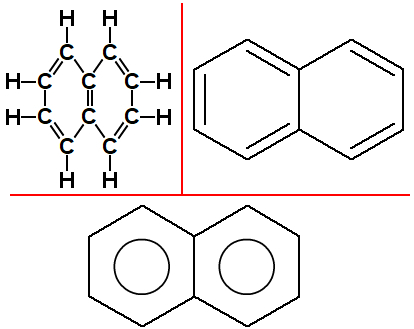
Fórmulas estruturais do naftaleno
Antraceno: substância formada por três estruturas aromáticas. A estrutura central apresenta uma ligação dupla e dois átomos de carbono em comum com cada uma das estruturas presentes nas extremidades. Sua fórmula molecular é C14H10.
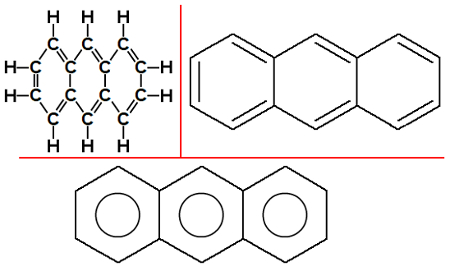
Fórmulas estruturais do Antraceno
Fenantreno: substância formada por três estruturas aromáticas. A estrutura central apresenta uma ligação dupla e dois átomos de carbono em comum com cada uma das estruturas presentes nas extremidades. A diferença em relação ao antraceno é a disposição espacial de um dos anéis benzênicos. Sua fórmula molecular é C14H10.
Fórmulas estruturais do Fenantreno
Propriedades
-
Compostos que se apresentam geralmente no estado líquido, em temperatura ambiente
-
Apresentam característica apolar
-
Interagem por meio de dipolo-induzido, ou seja, forças de Van der Waals de fraca interação
-
Não se dissolvem na água
-
São menos densos que a água
-
Possuem pontos de ebulição mais elevados que hidrocarbonetos de cadeia normal e de menor massa molar
-
São capazes de participar de reações orgânicas de adição e substituição
Utilizações
-
Alguns podem ser utilizados como combustíveis de aviões
-
Solvente de compostos apolares, como esmaltes
-
Fabricação de explosivos
Podem ser utilizados como matéria-prima para produção de:
-
Plásticos
-
Fertilizantes
-
Detergentes
-
Borrachas sintéticas
Por Me. Diogo Lopes Dias