A ligação covalente é uma modalidade de ligação química que ocorre quando dois átomos compartilham, entre si, um par de elétrons. Ela é exercida apenas por ametais, os quais possuem como característica uma alta afinidade eletrônica. O modelo de ligação covalente foi proposto inicialmente por Gilbert Newton Lewis, no ano de 1916, o qual criou estruturas para representá-los (as chamadas estruturas de Lewis).
A ligação covalente pode ser simples, dupla ou tripla, a depender do número de pares eletrônicos compartilhados. Havendo diferenças de eletronegatividade entre os átomos envolvidos, a ligação covalente pode também ser polar, com o surgimento de cargas parciais positivas e negativas. Os compostos covalentes podem ser sólidos, líquidos ou gasosos em temperatura ambiente, possuindo propriedades correlacionadas às forças intermoleculares exercidas por seus compostos.
Leia também: Ligação metálica — como os átomos de um elemento metálico interagem entre si
Tópicos deste artigo
- 1 - Resumo sobre ligação covalente
- 2 - Videoaula sobre ligação covalente
- 3 - O que é ligação covalente?
- 4 - Como acontece a ligação covalente?
- 5 - Tipos de ligações covalentes
- 6 - Exemplos de ligação covalente
- 7 - Ligação covalente polar e apolar
- 8 - Ligação covalente coordenada ou dativa
- 9 - Principais características das ligações covalentes
- 10 - Diferenças entre ligação covalente, ligação iônica e ligação metálica
- 11 - Exercícios resolvidos sobre ligação covalente
Resumo sobre ligação covalente
- A ligação covalente ocorre por meio do compartilhamento de um par de elétrons entre dois átomos.
- A ligação covalente é exercida por átomos de ametais.
- Apenas os elétrons de valência participam da formação da ligação covalente.
- Segundo Gilbert Newton Lewis, que propôs o modelo, os átomos se ligam para obedecer à regra do octeto.
- As ligações covalentes podem ser simples, duplas ou triplas.
- Havendo diferença de eletronegatividade entre os átomos envolvidos, a ligação covalente pode se tornar polar.
- A representação de compostos covalentes pode se dar por meio das estruturas de Lewis.
- Existem também as ligações covalentes coordenadas, nas quais o par de elétrons compartilhado é oriundo de um único átomo.
- Os compostos covalentes possuem propriedades que dependem das forças intermoleculares que serão exercidas por eles.
Videoaula sobre ligação covalente
O que é ligação covalente?
A ligação covalente é uma modalidade de ligação que ocorre por meio do compartilhamento de um par de elétrons entre dois átomos distintos. Isso cria uma região de alta densidade eletrônica entre os átomos que se mantêm por meio de uma distância internuclear específica com o surgimento de uma força atrativa.

A ligação covalente foi proposta por Gilbert Newton Lewis no ano de 1916, anterior às interpretações que viriam a surgir pelo desenvolvimento da mecânica quântica.
Como acontece a ligação covalente?
O que intrigou no entendimento inicial do funcionamento da ligação covalente foi o fato de que os átomos dos compostos mantidos por essas ligações competem igualmente pela densidade eletrônica (são ametais, de alta energia de ionização e alta afinidade eletrônica). Diferentemente dos compostos iônicos, em que íons de átomos de características antagônicas são mantidos por meio de atrações eletrostáticas.
Dessa forma, Lewis propôs que os átomos iriam compartilhar seus elétrons de valência (os de maior energia), formando uma região de grande densidade eletrônica e mantida por forças atrativas entre os núcleos dos átomos envolvidos e os elétrons compartilhados. Obviamente que para que tais forças atrativas se tornem mais significantes, mantendo a ligação, deve haver uma distância ótima e caraterística entre os núcleos dos átomos.
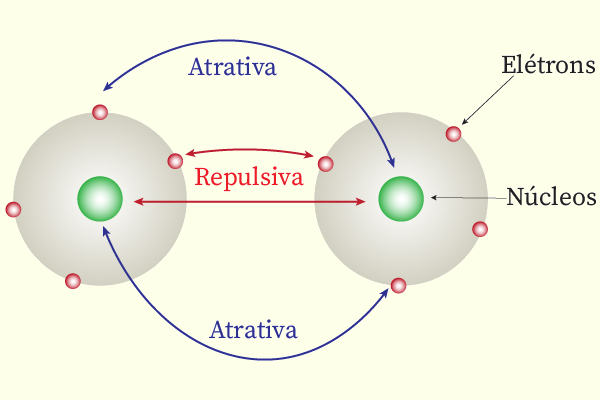
Lewis ainda determinou que os átomos iriam compartilhar elétrons até que adquirissem a mesma configuração eletrônica do gás nobre mais próximo na Tabela Periódica, a chamada regra do octeto (nome alusivo ao fato de os gases nobres, com exceção do hélio, terem oito elétrons de valência). A valência de um átomo, aliás, corresponde ao número de ligações que ele deve fazer para atingir a condição de octeto.
Leia também: Afinal, o que é a camada de valência?
Tipos de ligações covalentes
As ligações covalentes são formadas por meio do compartilhamento de um par de elétrons. Contudo, em diversas ocasiões, o número de pares de elétrons pode ser maior (dois ou três) para atingir as condições impostas pela regra do octeto. Assim, existe:
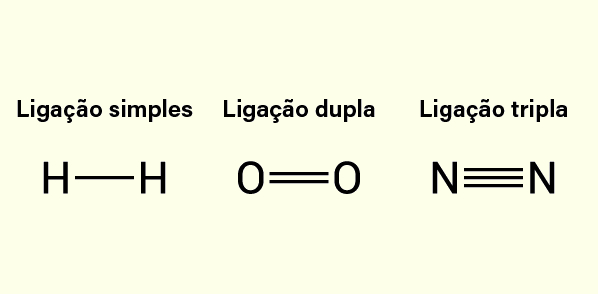
- Ligação covalente simples: ocorre quando apenas um par de elétrons é compartilhado entre dois átomos, sendo representada, nas estruturas de Lewis, por um bastão (—).
- Ligação covalente dupla: quando dois átomos compartilham entre si dois pares de elétrons, representada nas estruturas de Lewis por dois bastões (=).
- Ligação covalente tripla: quando dois átomos compartilham entre si três pares de elétrons há a formação da chamada ligação covalente tripla, representada nas estruturas de Lewis por três bastões (≡).
Exemplos de ligação covalente
-
Ligação covalente no gás flúor
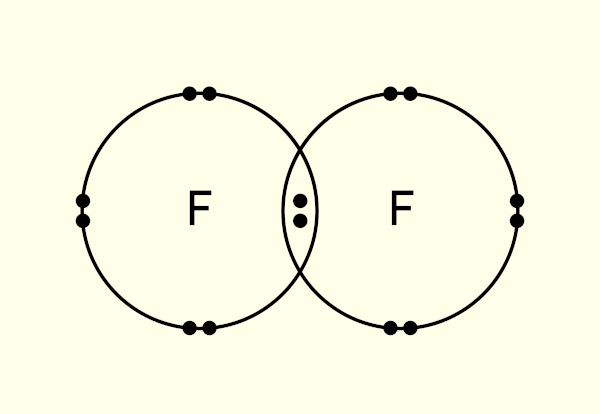
Vejamos o caso do gás flúor, de fórmula F2. Cada flúor apresenta sete elétrons na camada de valência (como os demais halogênios, aliás). Isso também pode ser confirmado por sua distribuição eletrônica: 1s2 2s2 2p5.
Assim sendo, mediante a regra do octeto, cada flúor precisa realizar uma ligação covalente simples para atingir o octeto, compartilhando assim um único par de elétrons, como mostra a imagem a seguir.
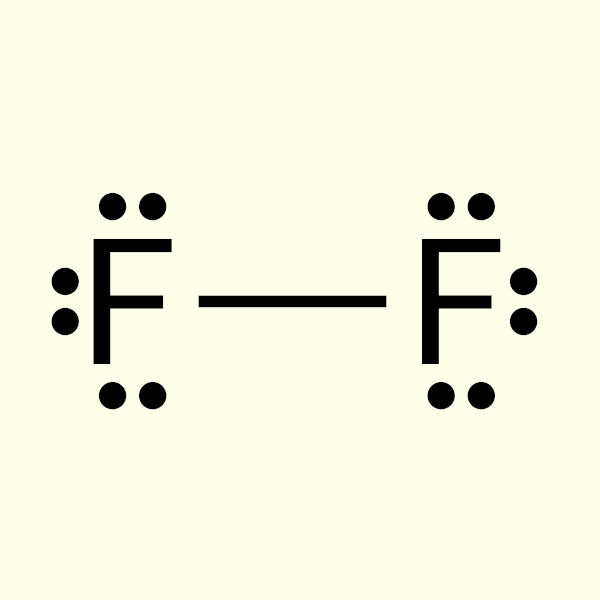
Uma forma de representar essa ligação covalente é também pela chamada estrutura de Lewis, com a ligação covalente sendo representada por um bastão.
-
Ligação covalente na água
Já na formação da água, H2O, vê-se que o oxigênio, com seis elétrons de valência (2s2 2p4), necessita de duas ligações covalentes para se estabilizar. O hidrogênio não completa octeto, tendo apenas um único elétron na camada de valência (1s1). Nesse caso, estabiliza-se realizando uma ligação covalente simples, adquirindo a configuração eletrônica do gás nobre hélio (1s2).
Assim, duas ligações covalentes simples serão formadas na estrutura da água, uma com cada hidrogênio, conforme mostra a figura.
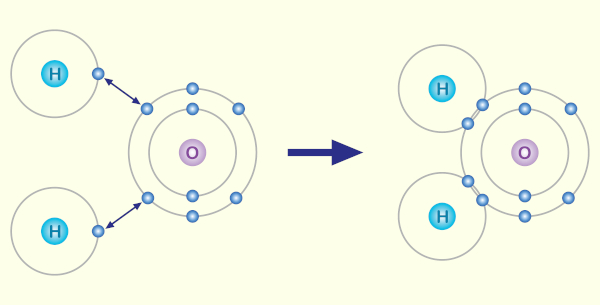
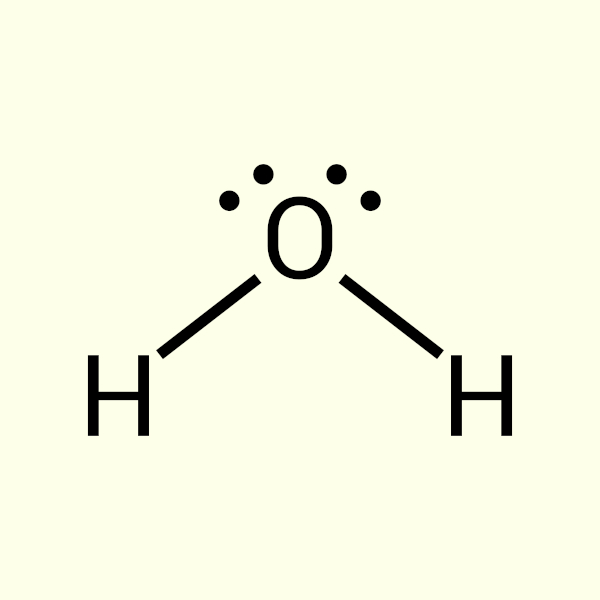
Assim, a estrutura de Lewis para a molécula de água pode ser representada da seguinte forma:
-
Ligação covalente no gás oxigênio
O gás oxigênio, O2, é uma molécula que apresenta uma ligação covalente dupla entre os átomos de oxigênio, uma vez que, como apresentam seis elétrons de valência, necessitam de duas ligações covalentes para atingir o octeto. Dessa forma, faz-se uma ligação covalente dupla entre os dois átomos de oxigênio:
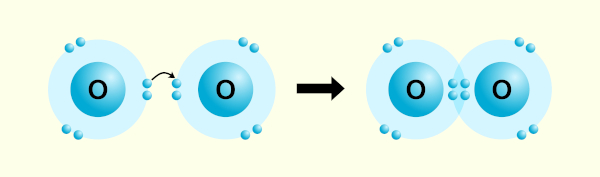
A estrutura de Lewis resultante para o O2 é, então:
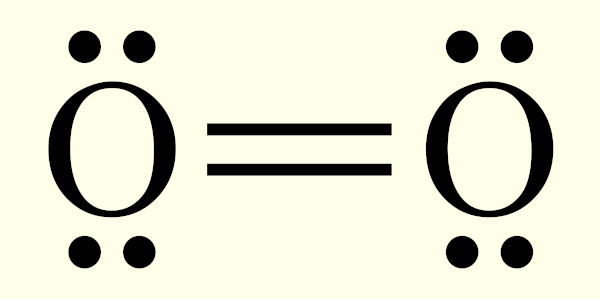
Ligação covalente polar e apolar
Quando átomos diferentes realizam uma ligação covalente há o surgimento de uma carga parcial sobre eles. Essa carga parcial surge porque, diante das diferenças dos átomos envolvidos, um átomo tem maior poder de atração que o outro, fazendo que haja maior probabilidade de o par de elétrons se encontrar próximo a esse átomo que possui maior poder de atração.
Quando a ligação covalente apresenta esse comportamento, dizemos que ela é uma ligação covalente polar, com a presença de uma região então negativa, por conta da maior densidade eletrônica, e outra região positiva, por conta da menor densidade eletrônica.
A capacidade que um átomo possui de atrair os elétrons da ligação covalente pode ser medida por uma propriedade conhecida como eletronegatividade. Dentre os átomos conhecidos, o flúor (F) é o que apresenta maior eletronegatividade (aproximadamente 4,0 na escala de Pauling), enquanto o frâncio (Fr) é o que apresenta a menor eletronegatividade (aproximadamente 0,7 na escala de Pauling).
Vejamos o exemplo do caso da ligação entre hidrogênio e cloro, para a formação do HCl. O cloro apresenta maior eletronegatividade (aproximadamente 3,2) que o hidrogênio (aproximadamente 2,2) e, por conta disso, há uma maior aproximação dos elétrons ao cloro, polarizando-se a ligação e com a formação de uma carga parcial (ou líquida) negativa sobre esse átomo. O hidrogênio, em uma região deficitária de elétrons, terá então uma carga parcial positiva. As cargas parciais, para se diferenciar das cargas pontuais dos íons, são representadas com a legra grega delta minúsculo (\(\delta\)).
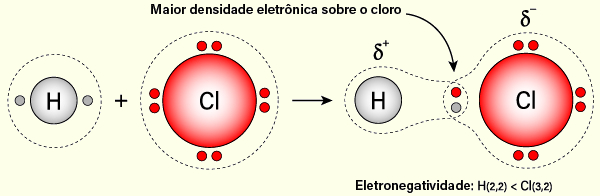
Em ligações covalentes formadas por átomos do mesmo elemento, como O2, F2, N2, não há diferença de eletronegatividade. Dessa forma, não há um movimento de polarização eletrônica e, por conta disso, essas ligações são ditas covalentes apolares. Assim sendo, é possível concluir que a polarização da ligação é consequência direta da diferença de eletronegatividade.
Ligação covalente coordenada ou dativa
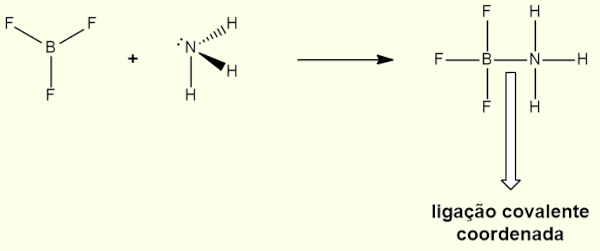
Uma ligação covalente coordenada ocorre quando ambos os elétrons vêm de um único átomo da ligação. O termo “ligação dativa” ainda é amplamente utilizado como sinônimo para ligação covalente coordenada, contudo a Iupac afirma que o termo é obsoleto e, assim sendo, deve ser evitado.
Essa ligação é muito perceptível quando um ácido de Lewis (aceptor de elétrons, eletrófilo) reage com uma base de Lewis (doadora de elétrons, nucleófila), para a formação de um aduto de Lewis. Um caso clássico ocorre na reação entre o BF3 (ácido de Lewis) e a amônia, NH3 (base de Lewis):
Principais características das ligações covalentes
A força das ligações covalentes varia de acordo com os átomos envolvidos, sendo mensurada por um parâmetro termodinâmico conhecido como energia de dissociação, que dá a energia necessária para romper 1 mol de ligação covalente, onde cada átomo fica com um dos átomos da ligação:
H—Cl (g) → ·H (g) + ·Cl (g)
A energia da ligação pode ser correlacionada com o comprimento delas. Ou seja, quanto maior o raio atômico, menos os núcleos podem se aproximar do par de elétrons que fica entre eles, o que enfrequece a ligação covalente. Da mesma forma, para os mesmos átomos envolvidos, uma ligação tripla sempre terá maior energia de dissociação (e menor comprimento) que uma ligação dupla e esta, por conseguinte, terá uma maior energia de dissociação (e menor comprimento) que uma ligação simples.
A tabela a seguir traz valores de energias de dissociação e comprimento de ligação.
|
Ligação |
Energia de dissociação (kJ.mol−1) |
Comprimento de ligação (pm) |
|
C—H |
412 |
109 |
|
C—C |
348 |
154 |
|
C=C |
612 |
134 |
|
C≡C |
837 |
120 |
|
N—H |
388 |
101 |
|
N≡N |
932 |
110 |
|
I—I |
139 |
268 |
|
Cl—Cl |
230 |
199 |
|
Br—Br |
181 |
228 |
|
H—H |
424 |
74 |
Além disso, os compostos covalentes podem existir como moléculas isoladas, diferentemente das estruturas cristalinas em compostos iônicos, em que as fórmulas unitárias não podem existir individualmente.
As propriedades físicas dos compostos covalentes são totalmente dependentes das interações intermoleculares. Por exemplo, compostos que exercem interações intermoleculares mais fortes possuirão maior ponto de fusão e ebulição. Compostos covalentes polares apresentam possibilidade de interações do tipo dipolo-dipolo, mais intensas que as interações dipolo induzido-dipolo induzido exercidas pelas moléculas apolares. Por isso, é possível encontrar compostos covalentes que são gases, líquidos ou sólidos em temperatura ambiente. Mesmo assim, as temperaturas de fusão e ebulição dos compostos covalentes são menores que de compostos iônicos de tamanho e massa semelhantes, visto que as interações iônicas são mais intensas.
Em tese, pela ausência de cargas, deveria-se esperar que compostos covalentes não conduzissem corrente elétrica na forma pura ou dissolvidos em água, mas nem sempre é assim.
O grafite, por exemplo, uma forma alotrópica do carbono, é um bom condutor de eletricidade no estado sólido, justamente por haver elétrons livres em sua estrutura, os quais podem originar uma corrente elétrica. Na estrutura do grafite, os átomos de carbono possuem elétrons deslocalizados, tal qual vemos em anéis aromáticos. São esses elétrons que podem se movimentar nas camadas de anéis de grafite, de forma semelhante aos metais.
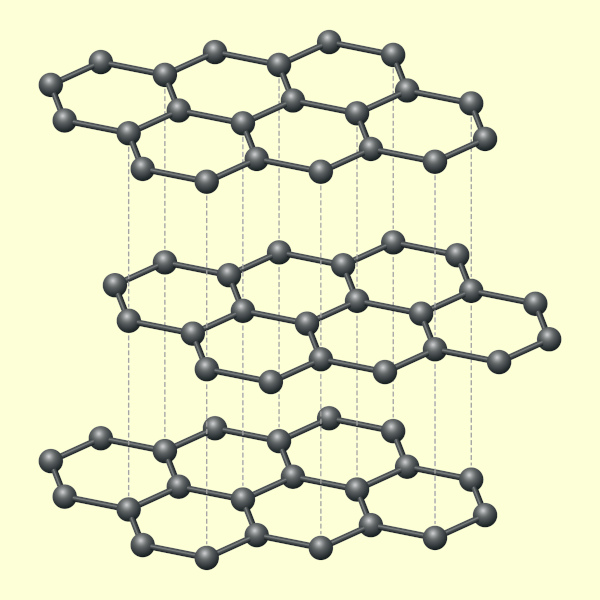
Alguns compostos covalentes polares, como é o caso do HCl, HI e HBr, dada sua alta polaridade, podem reagir com a água, sendo hidrolisados. Nessa reação de hidrólise há a formação de íons H3O+ e ânions, o que também permite a condução de corrente elétrica.
HCl + H2O → H3O+ (aq) + Cl− (aq)
Portanto, compostos covalentes, assim como iônicos e metálicos, também podem ser condutores de corrente elétrica.
Diferenças entre ligação covalente, ligação iônica e ligação metálica
A diferença entre ligações covalente, iônica e metálica está não só na natureza dos átomos envolvidos, mas também na forma como são realizadas.
No caso da ligação iônica, um cátion e um ânion são mantidos em uma rede cristalina por meio de atrações eletrostáticas de natureza coloumbianas. Os átomos que dão origem aos cátions e aos ânions possuem propriedades antagônicas. Por exemplo, enquanto um tem baixa energia de ionização e baixa afinidade eletrônica, o outro possui alta energia de ionização e alta afinidade eletrônica. Em geral, compostos iônicos são formados por metais e ametais.
Já na ligação metálica ocorre a combinação de diversos átomos metálicos, também em uma estrutura tridimensional e infinita. As camadas de valência dos metais se sobrepõem e dão origem a dois grandes níveis de energia. O nível menor, onde se alocam os elétrons utilizados para a ligação, é chamado de banda de valência. Já o nível maior, deficitário de elétrons, é chamado de banda condutora. É justamente o trânsito de elétrons entre a banda de valência e a banda condutora que explica a condutividade elétrica dos metais.
Leia também: Como determinar a geometria das moléculas
Exercícios resolvidos sobre ligação covalente
Questão 1
(USS-Univassouras Medicina/2024.1) O monóxido de carbono, CO, é um gás tóxico formado na combustão incompleta de compostos de carbono.
A ligação interatômica presente em cada molécula desse gás é classificada como:
- iônica.
- metálica.
- covalente.
- de hidrogênio.
Resposta: Letra C.
O monóxido de carbono é formado por dois ametais, carbono e oxigênio, os quais se ligam apenas por ligações covalentes.
Questão 2
(UFSM/2024) “Uma dieta equilibrada é tão indispensável para os nossos companheiros de quatro patas como para nós, assumindo um papel crucial no que toca a saúde, bem-estar e esperança de vida. O fornecimento adequado de todos os nutrientes vitais mantém o organismo do animal em forma, aumentando a sua imunidade e resistência e prevenindo problemas de saúde. [...] Tal como as vitaminas, os minerais são fundamentais para qualquer cão. Os minerais essenciais têm funções e propriedades muito particulares no organismo. É feita a distinção entre oligoelementos (ferro, cobre, zinco, manganês, cobalto, iodo, selênio, flúor) e macroelementos (cálcio, fósforo, magnésio, sódio, potássio).”
Fonte: ZOOPLUS MAGAZINE. Disponível em: https://www.zooplus.pt/magazine/caes/ comida-para-cao/nutrientes-essenciais-para-caes. Acesso em: 05 out. 2023. (Adaptado)
Os oligoelementos e macroelementos são compostos inorgânicos que podem se ligar através de ligações iônicas ou ligações covalentes.
Possuem ligações covalentes os compostos a seguir, EXCETO
- Dióxido de selênio (SeO2 (s)).
- Nitrogênio (N2 (g)).
- Cloreto de ferro III (FeCl3 (s)).
- Oxigênio (O2 (g)).
- Flúor (F2 (g)).
Resposta: Letra C.
O cloreto de ferro III é uma espécie iônica, visto que é formado pela ligação entre um metal e um ametal. Os demais compostos são formados única e exclusivamente por ametais e, por isso, possuem ligação covalente.
Fontes
ATKINS, P.; JONES, L.; LAVERMAN, L. Príncípios de Química: Questionando a vida e o meio ambiente. 7. ed. Porto Alegre: Bookman, 2018.
DO CANTO, E. L.; LEITE, L. L. C.; CANTO, L. C. Química – na abordagem do cotidiano. 1. ed. São Paulo: Moderna, 2021.
INTERNATIONAL OF PURE AND APPLIED CHEMISTRY – IUPAC. Compendium of Chemical Terminology – IUPAC Recommendations (Gold Book). Disponível em: < https://goldbook.iupac.org/>.
LING, T. Why does graphite conduct electricity? BBC Science Focus. 19 dez. 2020. Disponível em: < https://www.sciencefocus.com/science/why-does-graphite-conduct-electricity>. Acesso em 31 ago. 2024.

