Polimerização é o processo químico que resulta na formação de macromoléculas, conhecidas como polímeros, a partir da ligação de moléculas menores, os monômeros. Imagine construir uma longa cadeia com pequenos elos: os monômeros são os elos, e o polímero é a cadeia completa.
Existem diversos tipos de polimerização, cada um com suas características e mecanismos específicos. A escolha do tipo de polimerização dependerá das propriedades desejadas para o polímero final. A reação de polimerização pode ocorrer por diferentes mecanismos, como reações em cadeia (adição) ou reações de condensação.
As técnicas de polimerização também influenciam significativamente as propriedades dos polímeros. A temperatura, a pressão, a presença de catalisadores e a concentração dos reagentes são alguns dos fatores que podem afetar o grau de polimerização, ou seja, o comprimento médio da cadeia polimérica. Um grau de polimerização maior geralmente resulta em polímeros com propriedades mecânicas e térmicas superiores.
Leia também: Qual é a composição química do látex?
Tópicos deste artigo
- 1 - Resumo sobre polimerização
- 2 - Tipos de polimerização
- 3 - Reação de polimerização
- 4 - Técnicas de polimerização
- 5 - Grau de polimerização
- 6 - Exercícios resolvidos sobre polimerização
Resumo sobre polimerização
- Polimerização é a reação de formação de macromoléculas, conhecidas como polímeros, a partir da ligação de monômeros, que são moléculas menores.
- Os principais tipos de polimerização são a polimerização por adição e a polimerização por condensação.
- A reação de polimerização é um processo de formação de macromoléculas, conhecidas como polímeros, a partir da ligação de moléculas menores, os monômeros.
- As técnicas de polimerização podem ser classificadas de acordo com a natureza do meio reacional, sendo divididas em sistemas homogêneos e heterogêneos.
- O grau de polimerização (GP) representa o número médio de unidades monoméricas (moléculas menores) que se repetem e se ligam para formar uma cadeia polimérica.
Tipos de polimerização
Os principais tipos de polimerização são a polimerização por adição e a polimerização por condensação.
→ Polimerização por adição
Na polimerização por adição, os monômeros se unem diretamente, sem a eliminação de pequenas moléculas. Esse tipo de reação é caracterizado por uma alta velocidade e um alto grau de polimerização. O mecanismo da polimerização por adição pode ser tanto radicalar (homolítico) quanto iônico (heterolítico).
- Mecanismo radicalar: nessa reação, um radical livre inicia a cadeia polimérica, reagindo com um monômero e formando um novo radical. Esse novo radical reage com outro monômero, e assim sucessivamente, até que a cadeia seja terminada por alguma reação.
- Mecanismo iônico: a polimerização iônica pode ser catiônica ou aniônica, dependendo se o iniciador é um ácido de Lewis ou uma base de Lewis.
A polimerização do etileno para formar polietileno é um exemplo clássico de polimerização por adição, que ocorre via mecanismo radicalar.
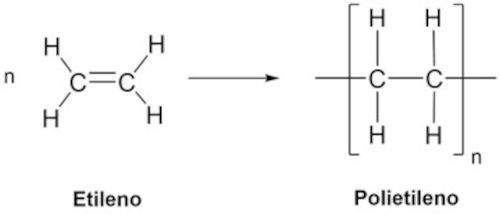
→ Polimerização por condensação
Na polimerização por condensação, a formação da ligação entre os monômeros ocorre com a eliminação de uma molécula pequena, como água, álcool ou amônia. Esse tipo de reação é geralmente mais lento que a polimerização por adição e resulta em polímeros com um grau de polimerização menor.
A formação do náilon a partir de ácido dicarboxílico e diamina é um exemplo de polimerização por condensação.
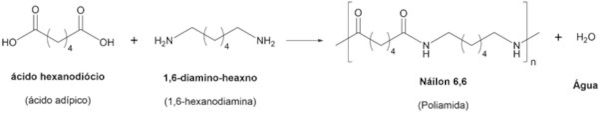
A tabela a seguir resume, de forma comparativa, as principais características das reações de polimerização por adição e por condensação.
|
Característica |
Polimerização por adição |
Polimerização por condensação |
|
Mecanismo |
Radicalar ou iônico |
Condensação |
|
Velocidade |
Alta |
Baixa |
|
Grau de polimerização |
Alto |
Baixo |
|
Eliminação de moléculas |
Não |
Sim |
|
Exemplos |
Polietileno, polipropileno |
Náilon, poliéster |
Veja também: Como é feito o plástico PET
Reação de polimerização

A reação de polimerização é um processo químico fundamental que resulta na formação de macromoléculas, conhecidas como polímeros, a partir da ligação de moléculas menores, os monômeros. Essa reação é de extrema importância para a indústria, pois é responsável pela produção de uma vasta gama de materiais, desde plásticos e fibras têxteis até polímeros utilizados em biomateriais e nanotecnologia. Existem dois principais tipos de polimerização: por adição e por condensação.
Na polimerização por adição, os monômeros se unem diretamente, sem a perda de átomos. Um exemplo clássico é a formação do polietileno, através do etileno. Na presença de um iniciador, como um radical livre, a dupla ligação do etileno se rompe, formando um sítio reativo que pode se ligar a outro monômero. Esse processo se repete inúmeras vezes, formando uma longa cadeia de carbono, como mostra a imagem a seguir.
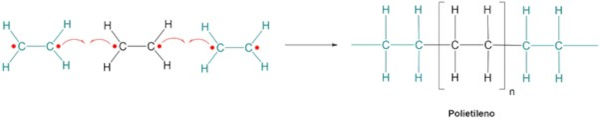
O mecanismo da polimerização por adição do etileno pode ser entendido através de três etapas:
- Iniciação: o iniciador se decompõe, formando um radical livre.
- Propagação: o radical livre reage com o monômero, formando um novo radical. Esse novo radical reage com outro monômero, e assim sucessivamente, alongando a cadeia.
- Terminação: a cadeia de crescimento pode ser terminada por diferentes mecanismos, como combinação de dois radicais ou reação com uma impureza.
Na polimerização por condensação, a ligação entre os monômeros ocorre com a eliminação de uma molécula pequena, como água ou álcool. Um exemplo comum é a formação de poliésteres a partir de diácidos e dióis.
O ácido tereftálico e o etilenoglicol são exemplos de monômeros utilizados na produção de poliéster. Ao reagirem, formam-se ligações éster e uma molécula de água é eliminada, como mostra a imagem a seguir.
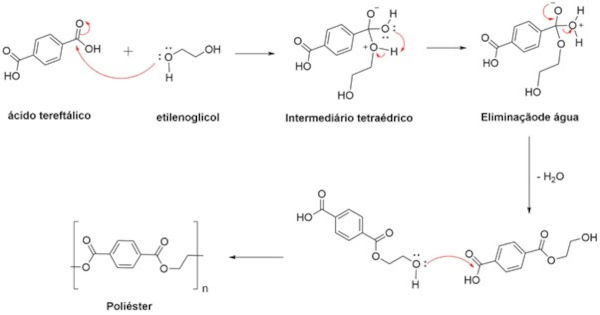
O mecanismo de formação do poliéster pode ser descrito através de duas etapas:
- Reação entre um grupo funcional de cada monômero: o grupo hidroxila do etilenoglicol ataca o carbono de carbonila do ácido tereftálico, formando um intermediário tetraédrico e, em seguida, eliminando uma molécula de água, que leva à formação do éster.
- Continuação da cadeia: o novo monômero formado pode reagir com outro monômero, e assim sucessivamente, alongando a cadeia.
Técnicas de polimerização
As técnicas de polimerização podem ser classificadas de acordo com a natureza do meio reacional, sendo divididas em sistemas homogêneos e heterogêneos.
→ Sistemas homogêneos
Nesses sistemas, o monômero e o iniciador se encontram em uma única fase, geralmente líquida. As principais técnicas de polimerização em sistemas homogêneos são:
- Polimerização em massa (ou bloco):
- O monômero puro é polimerizado sem a adição de solventes ou outros componentes.
- Vantagens: alta pureza do polímero, fácil processo.
- Desvantagens: dificuldade de controle da temperatura, viscosidade elevada, possibilidade de reações exotérmicas violentas.
- Aplicações: produção de resinas, adesivos e materiais ópticos.
- Polimerização em solução:
- O monômero é dissolvido em um solvente inerte.
- Vantagens: melhor controle da temperatura, menor viscosidade, maior facilidade de remoção do calor.
- Desvantagens: necessidade de remover o solvente após a polimerização, contaminação do polímero pelo solvente.
- Aplicações: produção de polímeros de alta pureza, como aqueles utilizados em eletrônicos e dispositivos médicos.
→ Sistemas heterogêneos
Nesses sistemas, o meio reacional é composto por duas ou mais fases, o que confere características particulares ao processo de polimerização. As principais técnicas de polimerização em sistemas heterogêneos são:
- Polimerização em emulsão:
- O monômero é disperso em pequenas gotículas em um meio aquoso, estabilizadas por um emulsificante.
- Vantagens: alta taxa de polimerização, baixo peso molecular, fácil controle do tamanho das partículas.
- Desvantagens: presença de emulsificante no polímero final, necessidade de purificação.
- Aplicações: produção de látex, adesivos, tintas e elastômeros.
- Polimerização em suspensão:
- O monômero é disperso em pequenas gotas em um meio aquoso, sem a presença de um emulsificante.
- Vantagens: produção de polímeros com maior tamanho de partícula, fácil remoção do polímero.
- Desvantagens: maior viscosidade do meio reacional, possibilidade de aglomeração das partículas.
- Aplicações: produção de resinas termoplásticas, como o poliestireno.
- Polimerização interfacial:
- A polimerização ocorre na interface entre duas fases imiscíveis, como água e óleo.
- Vantagens: formação de filmes poliméricos finos e uniformes.
- Desvantagens: processo complexo, limitado a certos tipos de monômeros.
- Aplicações: produção de membranas, revestimentos e microcápsulas.
- Polimerização em fase gasosa:
- O monômero é polimerizado na fase gasosa, geralmente em um reator de fluxo.
- Vantagens: alta pureza do polímero, fácil controle do processo.
- Desvantagens: necessidade de altas temperaturas e pressões, equipamentos especializados.
- Aplicações: produção de polímeros de alta densidade, como o polietileno de alta densidade (Pead).
A escolha da técnica de polimerização adequada depende de diversos fatores, como o tipo de monômero, as propriedades desejadas do polímero final, a escala de produção e os aspectos econômicos.
Grau de polimerização
O grau de polimerização (GP) representa o número médio de unidades monoméricas (moléculas menores) que se repetem e se ligam para formar uma cadeia polimérica. Em outras palavras, é uma medida do tamanho médio da molécula do polímero. Quanto maior o GP, mais longa é a cadeia polimérica e, consequentemente, diferentes serão as propriedades do material resultante.
O grau de polimerização exerce uma influência significativa nas propriedades físicas e químicas dos polímeros, como:
- Viscosidade: polímeros com alto GP tendem a apresentar maior viscosidade em solução.
- Resistência mecânica: o aumento do GP geralmente leva a um aumento na resistência e na rigidez do material.
- Temperatura de transição vítrea (Tg): o GP pode afetar a Tg, que é a temperatura na qual um polímero passa de um estado vítreo para um estado mais elástico.
- Solubilidade: o GP pode influenciar a solubilidade do polímero em diferentes solventes.
Vários fatores podem influenciar o GP durante o processo de polimerização, incluindo:
- Natureza dos monômeros: a estrutura química dos monômeros e suas reatividades influenciam a velocidade e o mecanismo da polimerização.
- Concentração dos monômeros: a concentração dos monômeros afeta a probabilidade de colisões e reações entre eles.
- Temperatura: a temperatura influencia a velocidade das reações de polimerização e a formação de cadeias poliméricas.
- Presença de iniciadores e catalisadores: iniciadores e catalisadores aceleram a polimerização e podem influenciar o crescimento das cadeias.
- Tempo de reação: o tempo de reação permite que as cadeias poliméricas cresçam e atinjam determinado GP.
O GP pode ser calculado experimentalmente a partir da massa molar média do polímero e da massa molar do monômero:
\(GP = \frac {Massa\ molar\ média\ do\ polímero}{Massa\ molar\ do\ monômero}\)
Existem diversas técnicas para determinar o GP de um polímero, sendo a viscosidade intrínseca um dos métodos mais comuns. A viscosidade intrínseca está relacionada à massa molar do polímero, logo, quanto maior o GP, maior será a viscosidade intrínseca da solução. Outros métodos incluem cromatografia de permeação em gel (GPC), espectroscopia e osmometria.
Saiba mais: Plástico verde — polímero de origem renovável que não contribui para o aquecimento global
Exercícios resolvidos sobre polimerização
1. (UFPI) As poliamidas são polímeros de condensação e são materiais sintéticos utilizados na fabricação de membranas de dessalinizadores de águas. Abaixo está a representação parcial de uma poliamida.
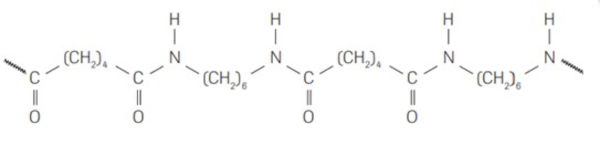
Entre as alternativas abaixo, marque aquela que apresenta os reagentes necessários para a obtenção da poliamida representada.
A) éster e etilenoglicol
B) ácido dicarboxílico e etilenoglicol
C) éster e amina primária
D) cloreto de ácido e éster
E) ácido dicarboxílico e diamina primária
Resolução: A resposta correta é a alternativa E: ácido dicarboxílico e diamina primária.
Análise da estrutura da poliamida: a estrutura da poliamida apresentada mostra um padrão repetitivo de ligações amida (-CONH-) que se alternam com cadeias de hidrocarbonetos. Essa estrutura é característica de polímeros formados pela reação de condensação entre um ácido dicarboxílico e uma diamina primária.
Reação de polimerização: a formação da poliamida ocorre através da reação de condensação entre o grupo carboxila (-COOH) do ácido dicarboxílico e o grupo amino (-NH2) da diamina primária. A cada ligação formada, uma molécula de água é eliminada.
Analisando as alternativas:
A) éster e etilenoglicol: a reação entre um éster e um diol (como o etilenoglicol) leva à formação de um poliéster, não de uma poliamida.
B) ácido dicarboxílico e etilenoglicol: assim como na alternativa A, essa reação também leva à formação de um poliéster.
C) éster e amina primária: a reação entre um éster e uma amina primária pode levar à formação de uma amida, mas não de uma poliamida, pois não há a formação de uma cadeia polimérica.
D) cloreto de ácido e éster: essa reação não é comum para a formação de poliamidas.
E) ácido dicarboxílico e diamina primária: correta. Conforme explicado anteriormente, a reação entre um ácido dicarboxílico e uma diamina primária é a reação característica para a formação de poliamidas.
2. A história da borracha natural teve início no século XVI, quando os exploradores espanhóis observaram os índios sul-americanos brincando com bolas feitas de um material extraído de uma árvore local, popularmente conhecida como seringueira. Do ponto de vista estrutural, sabe-se que essa borracha, chamada látex, é um polímero de isopreno, conforme ilustrado na reação a seguir.
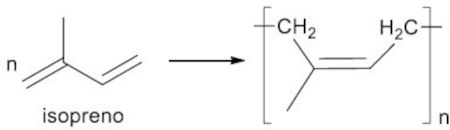
Com relação à estrutura do isopreno e à da borracha natural, analise as proposições.
I. A molécula de isopreno apresenta quatro carbonos com a configuração sp.
II. As duplas ligações do polímero formado apresentam configuração Z.
III. A borracha natural realiza ligações de hidrogênio entre suas cadeias.
IV. Segundo a nomenclatura oficial, a molécula de isopreno é denominada 3-metil-1,3-buteno.
Assinale a alternativa correta.
A) Somente a afirmativa IV é verdadeira.
B) Somente a afirmativa III é verdadeira.
C) Somente as afirmativas I e III são verdadeiras.
D) Somente as afirmativas II e IV são verdadeiras.
E) Somente a afirmativa II é verdadeira.
Resolução: A alternativa correta é a E) Somente a afirmativa II é verdadeira.
Análise de cada afirmativa:
I. A molécula de isopreno apresenta quatro carbonos com a configuração sp: Falsa. Os carbonos que fazem parte das duplas ligações possuem hibridização sp², não sp. A hibridização sp ocorre em moléculas lineares com duas ligações sigma e nenhuma ligação pi.
II. As duplas ligações do polímero formado apresentam configuração Z: Verdadeira. A borracha natural é um polímero com configuração Z nas duplas ligações, o que confere a ela suas propriedades elásticas.
III. A borracha natural realiza ligações de hidrogênio entre suas cadeias: Falsa. As ligações de hidrogênio ocorrem entre átomos de hidrogênio ligados a átomos eletronegativos (como oxigênio, nitrogênio ou flúor) e átomos eletronegativos de outra molécula. Na borracha natural, não há esses grupos funcionais capazes de formar ligações de hidrogênio.
IV. Segundo a nomenclatura oficial, a molécula de isopreno é denominada 3-metil-1,3-buteno: Falsa. A nomenclatura correta é 2-metil-1,3-butadieno. A numeração da cadeia principal deve iniciar pela extremidade que fornece os menores números para as insaturações.
Fontes
CAREY, Francis A. Química orgânica, vol. 1 e 2. 7. ed; Porto Alegre, RS: AMGH Ed., 2011.
CHANG, Raymond; Química Geral: conceitos essenciais. - 4. ed. - São Paulo: McGraw-Hill, 2007.
ROBERT G. JOHNSON; T.W.G. SOLOMONS; CRAIG B. FRYHLE – Química Orgânica, volume 1 e 2. LTC, 2013.

