A geometria angular é um dos diversos tipos de geometria molecular, que ainda podem ser linear, piramidal, trigonal plana, tetraédrica, etc. A geometria angular pode ser encontrada apenas em moléculas que apresentam as seguintes características:
-
Triatômicas, ou seja, possuem apenas três átomos;
-
Possuir, no mínimo, três nuvens eletrônicas no átomo central.
Obs.: Nuvem eletrônica é toda ligação covalente (simples, dupla, tripla ou coordenada) entre átomos e pares de elétrons da camada de valência que não estão participando de uma ligação.
Veja alguns exemplos de moléculas que apresentam geometria angular:
1º Exemplo: água (H2O)

Estrutura convencional da água
Na estrutura da água, temos:
-
Três átomos: dois hidrogênios e um oxigênio;
-
O oxigênio é o átomo central porque realiza um maior número de ligações (duas, por ser da família VIA);
-
Duas ligações simples entre o oxigênio e os hidrogênios. Isso porque cada hidrogênio só pode realizar uma ligação e o oxigênio duas ligações;
-
Quatro elétrons não ligantes no oxigênio, pois ele apresenta seis elétrons na camada de valência e utiliza apenas dois nas ligações.
Portanto, como na molécula de água há a presença de três átomos e quatro nuvens eletrônicas (duas ligações simples e dois pares de elétrons não ligantes) no átomo central, a geometria é angular.
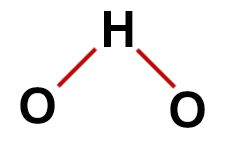
Fórmula estrutural correta da água
Obs.: Sempre que a molécula apresentar esses padrões, o ângulo formado entre os átomos é de aproximadamente 109º 28'.
2º Exemplo: Dióxido de enxofre (SO2)

Estrutura convencional do dióxido de enxofre
Na estrutura do dióxido de enxofre, temos:
-
Três átomos: dois oxigênios e um átomo de enxofre;
-
O enxofre é o átomo central por ser o elemento em menor quantidade da molécula, já que todos os elementos necessitam realizar o mesmo número de ligações (duas);
-
Uma ligação dupla entre o enxofre e um dos oxigênios. Isso porque ambos necessitam de duas ligações;
-
Uma ligação covalente coordenada ou dativa, pois o enxofre ficou estável após realizar a dupla com o outro oxigênio, mas ainda existe um átomo de oxigênio necessitando de dois elétrons;
-
Quatro elétrons não ligantes no oxigênio. Isso porque o oxigênio apresenta seis elétrons na camada de valência e utiliza apenas dois nas ligações.
Assim, como na molécula de dióxido de enxofre há a presença de três átomos e quatro nuvens eletrônicas (duas ligações simples e dois pares de elétrons não ligantes) no átomo central, a geometria é angular.
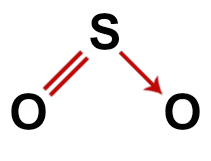
Fórmula estrutural correta do dióxido de enxofre
Obs.: Sempre que a molécula apresentar esses padrões, o ângulo formado entre os átomos é de aproximadamente 120o.
Por Me. Diogo Lopes Dias