Os metais são elementos químicos que apresentam como principal característica física a capacidade de perder elétrons e, consequentemente, formar cátions metálicos. Por essa razão, eles podem realizar dois tipos de ligações químicas: a ligação iônica e a ligação metálica.
A ligação iônica ocorre quando um metal interage com um elemento de natureza ametálica, que pode ser um ametal ou o hidrogênio. Nesse tipo de ligação, temos a perda de elétrons por parte dos metais e o ganho de elétrons por parte dos ametais ou do hidrogênio.
Já a ligação metálica é estabelecida entre os átomos de um único elemento metálico. Esse tipo de ligação ocorre apenas entre os átomos de um único metal e exclusivamente porque um metal não pode estabelecer ligação química com outro elemento metálico diferente.
Características gerais dos metais
-
Sólidos em temperatura ambiente, com exceção do mercúrio;
-
São brilhantes;
-
Apresentam elevados pontos de fusão e de ebulição;
-
Apresentam, em geral, cor prateada, com exceção do ouro, que é dourado, e do cobre, que é avermelhado;
-
Os metais puros são formados por aglomerados de átomos (de um único elemento químico) denominados de retículos cristalinos.
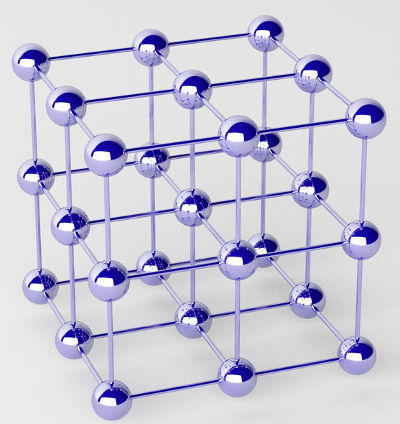
Representação do retículo cristalino de um metal
Princípios da ligação metálica
Na ligação metálica, os retículos cristalinos que formam os metais são, na verdade, um aglomerado iônico (composto apenas por cátions e elétrons). Os elétrons presentes na camada de valência dos átomos do metal são deslocalizados, ou seja, saem da camada de valência, fazendo com que o átomo se torne um cátion (deficiente em elétrons).
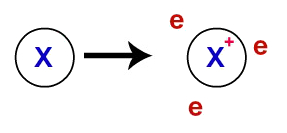
Representação dos elétrons deslocalizados da camada de valência
Após serem deslocalizados, os elétrons provenientes dos átomos do metal passam a rodear os cátions, formando um verdadeiro “mar de elétrons''. Cada um dos elétrons presentes nesse mar possui capacidade de mover-se por meio do retículo cristalino do metal livremente.
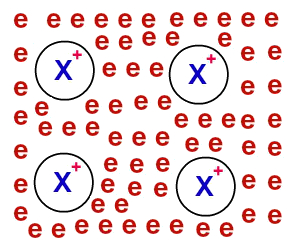
Representação do modelo do mar de elétrons
OBS.: Os elétrons “do mar” não são capazes de abandonar o retículo cristalino e movimentam-se por ele.
Propriedades dos metais justificadas pela ligação metálica
a) Maleabilidade
Por meio de um metal, é possível produzir chapas de diversas espessuras e lâminas. É graças a essa propriedade dos metais que podemos construir diversos objetos, como facas, espadas etc.

A lâmina de uma espada é feita a partir de um metal
b) Condutibilidade
Os metais, de uma forma geral, são bons condutores de corrente elétrica e calor. Quando um metal qualquer está em contato com uma fonte de calor ou com uma fonte de corrente elétrica, ele é capaz de conduzi-los.

Uma panela de alumínio na chama de um fogão fica inteiramente quente em virtude da condutividade
c) Ductibilidade
Por meio de um metal, podemos produzir fios. A utilização de um metal na forma de fios facilita a sua utilização, principalmente em relação à condutibilidade elétrica.

Um metal, como o cobre, pode ser utilizado para a produção de fios
Por Me. Diogo Lopes Dias
