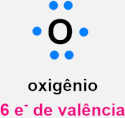
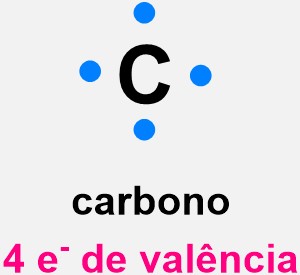
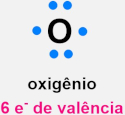
A regra do octeto é um princípio da química que ajuda a entender o fato de os átomos formarem ligações entre si, e também a formação dos íons, com base na estabilidade dos gases nobres. Essa regra diz que um átomo alcança sua estabilidade química ao preencher a sua camada de valência (camada mais externa) com oito elétrons, adotando a configuração eletrônica de um gás nobre.
A regra do octeto explica o fato de alguns átomos ganharem ou perderem elétrons ao interagirem com outros, originando íons, como no caso do NaCℓ. Essa regra foi apresentada por Gilbert Lewis, em 1916, e representou um marco para a química, possibilitando avanços significativos na compreensão da composição estrutural da matéria.
Leia também: Quais são os gases nobres e por que eles recebem esse nome?
Tópicos deste artigo
- 1 - Resumo sobre regra do octeto
- 2 - Videoaula sobre regra do octeto
- 3 - O que é a regra do octeto?
- 4 - O que diz a regra do octeto?
- 5 - Exemplos da regra do octeto
- 6 - Exceções à regra do octeto
- 7 - Exercícios resolvidos sobre regra do octeto
Resumo sobre regra do octeto
- A regra do octeto é um princípio da química que ajuda a prever a estabilidade de átomos e íons com base na composição eletrônica de suas camadas externas (camada de valência).
- A regra do octeto diz que um átomo, ou íon, adquire a estabilidade ao atingir a configuração eletrônica de um gás nobre, com 8 elétrons na camada de valência.
- Entre os átomos que seguem a regra do octeto, destacam-se os gases nobres: Ne, Ar, Kr, Xe, Rn e Og. Porém, essa regra também é seguida por íons, como Na+, K+, Mg2+, Ca2+, Cℓ−, I− e F−.
- Entre as exceções à regra do octeto, estão o hélio e o hidrogênio, que se estabilizam com um dueto, apenas 2 elétrons.
- O átomo de berílio (estável com 4 elétrons de valência) e o boro (estável com 6 elétrons de valência) também são exceções à regra e se estabilizam com 6 elétrons de valência.
- Algumas moléculas apresentam número ímpar de elétrons totais, impossibilitando que alguns dos átomos completem o octeto, como no caso do NO.
- Átomos do bloco p, que estão entre o 3° e 6° período da Tabela Periódica, podem expandir o octeto, ou apresentar octeto expandido, isto é, mais de 8 elétrons de valência.
Videoaula sobre regra do octeto
O que é a regra do octeto?

A regra do octeto é um princípio fundamental da química que prevê a estabilidade de átomos e íons com base na quantidade de elétrons na camada mais externa, também chamada de camada de valência. Essa regra foi proposta por Gilbert Lewis, em 1916, na tentativa de justificar a formação de ligações químicas entre os compostos e explicar a estabilidade observada nos gases nobres.
Lewis observou que os gases nobres, com exceção do hélio, apresentavam 8 elétrons na sua camada mais externa. Isso o levou a deduzir que esses gases são inertes por apresentarem suas camadas mais externas totalmente preenchidas. A observação feita por Lewis foi utilizada para justificar o fato de átomos se ligarem entre si, originando os compostos. Para Lewis, os átomos se ligavam entre si para alcançar a estabilidade de um gás nobre, preenchendo suas camadas de valências com 8 elétrons.
O que diz a regra do octeto?
A regra do octeto diz que um átomo precisa ter oito elétrons na camada de valência para que seja possível alcançar a estabilidade química, similar a um gás nobre. Com base nisso, átomos que apresentam octeto incompleto deveriam estabelecer ligações químicas, a fim de preencher o octeto. Essas ligações podem ocorrer através de ganho ou perda de elétrons, gerando íons através da ligação iônica ou através do compartilhamento de elétrons, que caracteriza a ligação covalente.
Na visão do Lewis, a formação do cloreto de sódio (NaCℓ) poderia ser justificada pelo preenchimento da camada de valência dos átomos, no qual o átomo de sódio (1s2 2s2 2p6 3s1) perde o seu elétron de valência e forma o cátion Na+ (1s2 2s2 2p6), alcançando a sua estabilidade com oito elétrons na camada mais externa, como mostra a imagem abaixo:
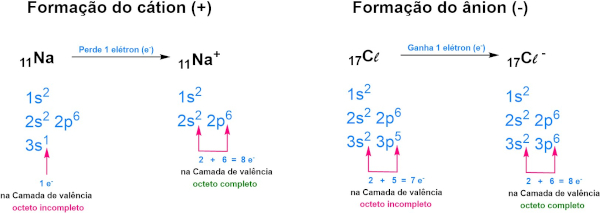
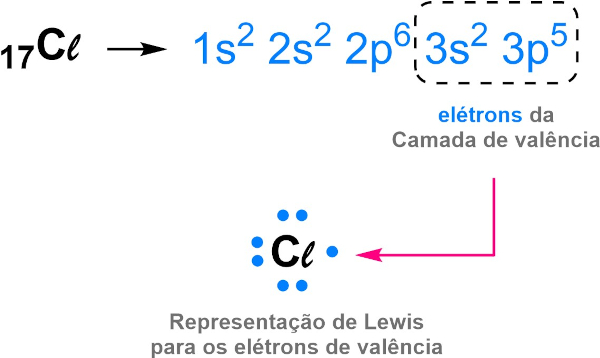
Já o cloro, com sete elétrons de valência (1s2 2s2 2p6 3s2 3p5), ganha o elétron do sódio, formando o íon Cℓ− (1s2 2s2 2p6 3s2 3p6), que passa a ser estável com oito elétrons na camada de valência. Essa ideia também foi utilizada para justificar a ligação em átomos de eletronegatividades próximas e do mesmo tipo, como no caso do Cℓ2.
Para ilustrar a ideia, Lewis desenvolveu um sistema de representação onde os elétrons de valência são representados como pontos ao redor do átomo. Essa forma de representação ficou conhecida como estrutura de Lewis, também chamada de estrutura eletrônica.
Na visão de Lewis, os átomos com eletronegatividade igual ou próxima, como os ametais, compartilhariam seus elétrons entre si e, assim, ambos passariam a ter o octeto completo. Esse compartilhamento de elétrons caracterizaria a ligação covalente. A imagem abaixo mostra a estrutura de Lewis na representação da ligação covalente na molécula do Cℓ2.
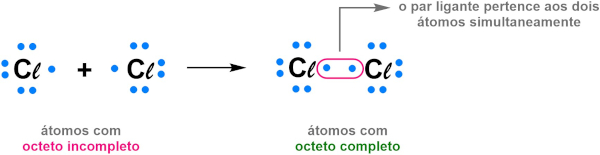
Após a ligação, cada átomo compartilha igualmente os dois elétrons do par ligante e, assim, completam seus octetos.
Veja também: Como é feita a distribuição eletrônica dos elétrons
Exemplos da regra do octeto
Várias substâncias de caráter iônico e covalente seguem a regra do octeto. A tabela a seguir mostra a composição eletrônica adotada pelos átomos ao estabelecerem ligações iônicas, em que o metal perde elétrons para ficar com o octeto completo, enquanto o ametal ganha os elétrons completando seu octeto.
|
Composto |
Cátion |
Configuração eletrônica |
Ânion |
Configuração eletrônica |
|
NaCℓ Cloreto de sódio |
Na+ |
1s2 2s2 2p6 |
Cℓ− |
1s2 2s2 2p6 3s2 3p6 |
|
MgO Óxido de magnésio |
Mg2+ |
1s2 2s2 2p6 |
O2− |
1s2 2s2 2p6 |
|
K2S Sulfeto de potássio |
K+ |
1s2 2s2 2p6 3s2 3p6 |
S2− |
1s2 2s2 2p6 3s2 3p6 |
O preenchimento do octeto nos compostos covalentes ocorre por compartilhamento de elétrons, onde cada átomo compartilha seus elétrons entre si e, assim, ambos completam seus octetos.
|
Composto |
Átomo com octeto incompleto |
Estrutura de Lewis (compartilhamento de elétrons) |
Estabilização do átomo após a ligação covalente |
|
H2O Água |
|
|
O atinge 8 e− na camada de valência |
|
|
H Estabiliza com 2 e− na camada de valência (exceção à regra do octeto) |
||
|
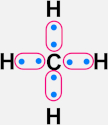
CH4 |
|
|
C atinge 8 e− na camada de valência |
|
|
H Estabiliza com 2 e− na camada de valência (exceção à regra do octeto) |
||
|
CO2 Gás carbônico |
|
|
C atinge 8 e− na camada de valência |
|
|
O atinge 8 e− na camada de valência |
||
|
N2 Gás nitrogênio |
|
|
N atinge 8 e− na camada de valência |
|
HCℓ |
|
|
C atinge 8 e− na camada de valência |
|
|
H Estabiliza com 2 e− na camada de valência (exceção à regra do octeto) |
Exceções à regra do octeto
Apesar de grande parte dos compostos serem formados a partir da regra do octeto, esse princípio não é definitivo para justificar a estabilidade e a formação de ligações nos compostos. Isso, porque existem compostos que não seguem essa regra. Os principais casos consistem em:
- estabilização por dueto,
- octeto incompleto,
- número ímpar de elétrons e
- expansão do octeto.
→ Estabilização por dueto
Alguns átomos e íons se estabilizam ao atingir um total de dois elétrons de valência, semelhantes ao gás hélio. O hidrogênio (H), por exemplo, é um átomo que segue essa tendência. Ele possui um único elétron de valência e apresenta comportamento de ametal, tendendo a formar ligações covalentes com outros ametais e ligações iônicas com metais alcalinos e alcalino-terrosos. Quando se liga a esses metais, forma hidreto como mostra a figura abaixo:
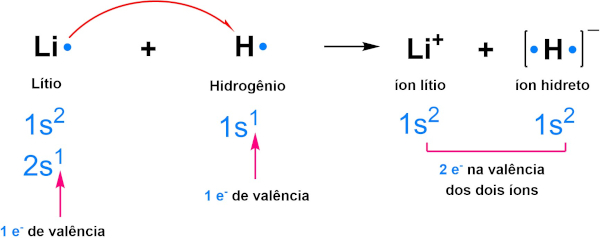
Como mencionado, o hidrogênio também forma ligações covalentes ao se ligar a outros ametais e, dessa forma, se estabiliza com dois elétrons através do compartilhamento de elétrons, como mostra a imagem abaixo:
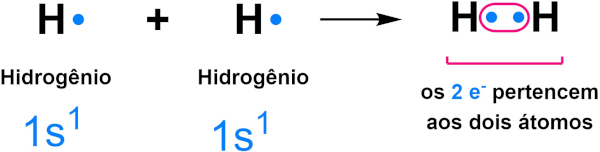
→ Octeto incompleto
Em algumas moléculas, o número de elétrons em torno do átomo central é menor que oito. Um exemplo disso é o hidreto de berílio (BeH2), onde o berílio (Be) mesmo pertencendo ao grupo dos metais alcalino-terrosos, foge da tendência do seu grupo e se estabiliza formando ligações covalentes.

Isso ocorre porque o Be, que tem distribuição 1s2 2s2, tem os seus orbitais s se misturando aos orbitais p, formando orbitais híbridos, devido a uma excitação dos elétrons. Outro exemplo de átomo que apresenta octeto incompleto é o átomo de boro (B), que apresenta distribuição 1s2 2s2 2p1, com 3 elétrons de valência. O boro tende a formar três ligações covalentes, gerando uma estabilização com seis elétrons de valência, como exemplificado abaixo na molécula do BF3:
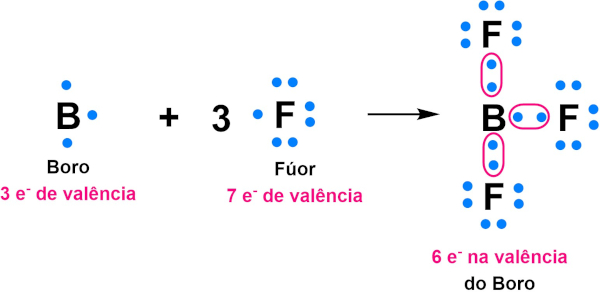
O flúor, que apresenta distribuição 1s2 2s2 2p5, apresenta sete elétrons na camada de valência. Como resta apenas um elétron para completar o seu octeto, o flúor tende a formar uma única ligação química para alcançar o octeto.
→ Número ímpar de elétrons
Algumas moléculas alcançam a estabilização com um número ímpar de elétrons. É o caso do NO, formado por nitrogênio (N), que possui distribuição 1s2 2s2 2p3, e oxigênio (O), que tem distribuição 1s2 2s2 2p4. Assim, no NO, o nitrogênio tende a ficar com o octeto incompleto devido a sua menor eletronegatividade, quando comparada ao oxigênio, como descrito na imagem a seguir.
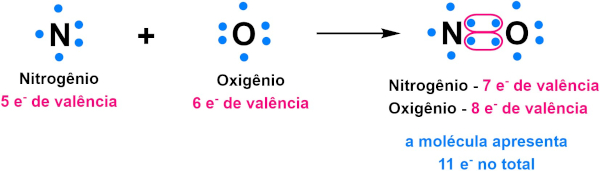
→ Expansão do octeto
Átomos que pertencem ao bloco p e que estão localizados entre o 3° e o 6° período da Tabela Periódica, podem expandir o octeto. É o caso do enxofre (S), presente no hexafluoreto de enxofre (SF6), ilustrado na imagem a seguir.
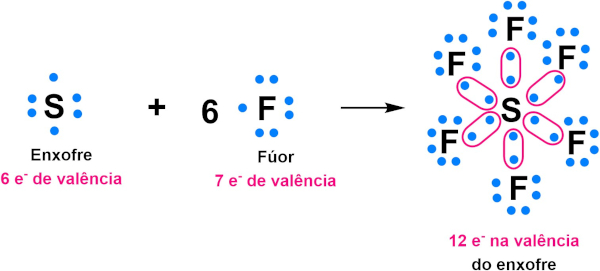
O enxofre (S), que apresenta distribuição eletrônica 1s2 2s2 2p6 3s2 3p4, apresenta seis elétrons de valência, restando-lhe apenas dois elétrons para completar o octeto. Porém, ao se ligar aos seis átomos de flúor, no SF6, acaba ultrapassando os oito elétrons previstos pela regra. Isso ocorre porque átomos que estão entre o terceiro e o sexto período da Tabela Periódica apresentam orbitais do tipo d e f, o que lhes permitem a alocação de um maior número de elétrons na camada de valência.
Saiba mais: Quais são os metais da Tabela Periódica?
Exercícios resolvidos sobre regra do octeto
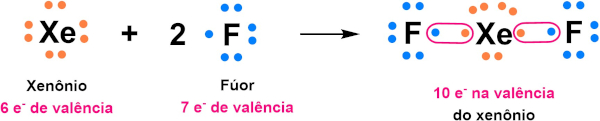
Questão 1: (Enem 2019) Por terem camada de valência completa, alta energia de ionização e afinidade eletrônica praticamente nula, considerou-se por muito tempo que os gases nobres não formariam compostos químicos. Porém, em 1962, foi realizada com sucesso a reação entre o xenônio (camada de valência 5s2 5p6) e o hexafluoreto de platina e, desde então, mais compostos novos de gases nobres vêm sendo sintetizados. Tais compostos demonstram que não se pode aceitar acriticamente a regra do octeto, na qual se considera que, numa ligação química, os átomos tendem a adquirir estabilidade assumindo a configuração eletrônica de gás nobre. Dentre os compostos conhecidos, um dos mais estáveis é o difluoreto de xenônio, no qual dois átomos do halogênio flúor (camada de valência 2s2 2p5) se ligam covalentemente ao átomo de gás nobre para ficarem com oito elétrons de valência.
Ao se escrever a fórmula de Lewis do composto de xenônio citado, quantos elétrons na camada de valência haverá no átomo do gás nobre?
A) 6
B) 8
C) 10
D) 12
E) 14
Resposta: C
Comentário: O xenônio é um gás nobre e, por isso, já apresenta 8 elétrons na sua camada de valência. Ao formar o difluoreto de xenônio, esse gás se liga a 2 átomos de flúor de forma covalente. Através do compartilhamento, ganha 1 elétron de cada flúor e, por isso, fica com um total de 10 elétrons na sua camada de valência.
Questão 2: (UFAM 2019) A regra do octeto afirma que, quando os átomos estão envolvidos numa ligação, eles tendem a alcançar um octeto de elétrons em sua camada externa (de valência). Parte-se do princípio que, na natureza, todos os sistemas tendem a adquirir a maior estabilidade possível.
Das alternativas a seguir, qual composto faz com que todos os átomos (ou íons) obedeçam à regra do octeto?
A) NaH
B) TiCℓ4
C) BF3
D) PbI2
E) XeO3
Resposta: B
Resolução: Para verificar se a regra do octeto será seguida pelos átomos nos compostos, basta analisar a configuração da camada de eletrônica de cada átomo e o tipo de ligação possível entre os átomos.
NaH – Ligação iônica:
- Sódio (Na, Z = 11) – 1s2 2s2 2p6 3s1: ao perder o elétron de valência, fica com octeto completo (Na+: 1s2 2s2 2p6). Logo, segue a regra do octeto.
- Hidrogênio (H, Z = 1) – 1s1: ao ganhar o elétron, ele se estabiliza em um dueto (H−: 1s2). Por isso, não segue a regra do octeto.
TiCℓ4 – Ligação iônica:
- Titânio (Ti, Z = 22) – 1s2 2s2 2p6 3s2 3p6 4s2 3d2: ao se ligar ao cloro, perde os seus 4 elétrons de valência, 1 para cada átomo de cloro, e atinge o octeto (Ti+4: 1s2 2s2 2p6 3s2 3p6). Logo, segue a regra do octeto.
- Cloro (Cℓ, Z = 17) – 1s2 2s2 2p6 3s2 3p5: cada átomo de cloro ganha 1 elétron do titânio e isso gera o íon cloreto, que apresenta octeto completo (Cℓ−: 1s2 2s2 2p6 3s2 3p6). Por isso, também segue a regra do octeto.
BF3 – Ligação covalente:
- Boro (B, Z = 5) – 1s2 2s2 2p1: liga-se ao flúor covalentemente e é uma das exceções da regra do octeto, pois se estabiliza com 6 elétrons de valência, após o compartilhamento de elétrons com cada átomo de flúor. Por isso, não segue a regra do octeto.
- Flúor (F, Z = 9) – 1s2 2s2 2p5: cada átomo de flúor apresenta 7 elétrons de valência e, ao se ligar covalentemente ao boro, passa a ter 8 elétrons na camada de valência e se estabiliza. Logo, segue a regra do octeto.
PbI2 – Ligação predominantemente iônica:
- Chumbo (Pb, Z = 82) – 4f14 5d10 6s2 6p2: o átomo de chumbo não segue a regra do octeto e, ao se ligar ao iodo, passa a ter uma ligação predominantemente iônica devido à diferença de eletronegatividade do iodo. Assim, há perda de 2 elétrons de valência, 1 para cada átomo de iodo, porém o íon formado permanece com o octeto incompleto (Pb2+: 4f14 5d10 6s2).
- Iodo (Z = 52) – 4d10 5s2 5p5: cada átomo de iodo ganha 1 elétron do chumbo e isso gera o íon iodeto, que apresenta octeto completo (I−: 4d10 5s2 5p6). Por isso, segue a regra do octeto.
XeO3 – Ligação covalente:
- Xenônio (Xe, Z = 54) – 4d10 5s2 5p6: apesar de ser um gás nobre, o xenônio pode estabelecer ligações covalentes com átomos muito eletronegativos, como no caso do oxigênio. O xenônio compartilha 2 elétrons com cada átomo de oxigênio, o que o leva a ficar com um total 12 elétrons após as ligações. Como átomos abaixo do 3° período tendem a expandir o octeto, Xe não seguirá a regra do octeto.
- Oxigênio (O, Z = 8) – 1s2 2s2 2p4: cada átomo de oxigênio recebe 2 elétrons do xenônio através do compartilhamento e isso faz com que cada oxigênio passe a ter 8 elétrons na camada de valência, se estabilizando. Logo, segue a regra do octeto.
Dessa forma, fica claro que o único composto que faz com que todos os átomos (ou íons) obedeçam à regra do octeto é o da alternativa B: TiCℓ4.
Fontes
ATKINS, Peter; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente. 3ª ed.; Porto Alegre; Bookman; 2006.
CHANG, Raymond. Química Geral: Conceitos Essenciais. 4ªed.; São Paulo; McGraw-Hill;2007.