Alguns compostos não precisam ter oito elétrons na camada de valência para atingir a estabilidade, são por isso considerados exceções à Regra do Octeto. Aprenda agora por que alguns elementos escapam da obrigação de ter um octeto de elétrons na última camada.
Berílio (Be)
É uma exceção à Regra do Octeto porque é capaz de formar compostos com duas ligações simples, sendo assim, estabiliza-se com apenas quatro elétrons na camada de valência.
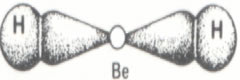
Como o hidrogênio (H) precisa ceder dois elétrons para realizar a ligação (H ― Be ― H), o átomo de Berílio (Be) compartilha seus elétrons e atinge a estabilidade.
Alumínio (Al)
É uma exceção à Regra do Octeto porque atinge a estabilidade com seis elétrons na camada de valência. O átomo de Alumínio tende a doar seus elétrons e assim pode formar três ligações simples com outros átomos:
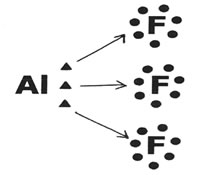
Neste caso, o Alumínio (Al) formou três ligações com três átomos de Flúor (F).
Boro (B)
Forma substâncias moleculares com três ligações simples.
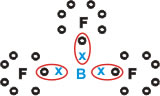
Repare que o Boro (B) tem a tendência de doar seus elétrons para os átomos de Flúor (F), este sim obedece à Regra do Octeto, necessitando de oito elétrons na camada de valência. Como o Boro cede seus elétrons, o flúor se estabiliza com o Octeto formado.
Por Líria Alves
Graduada em Química
Equipe Brasil Escola
Veja mais!

