Camada de valência é a camada (ou nível) mais externa (mais distante do núcleo) de um átomo, ou seja, aquela que está mais distante do núcleo. Assim sendo, ela apresenta os chamados elétrons mais externos ou elétrons de valência.
O número de níveis que um átomo pode apresentar varia de 1 a 7, os quais possuem os seguintes subníveis (em amarelo):
-
nível K (1ª camada): subnível s
-
nível L (2ª camada): subníveis s e p
-
nível M (3ª camada): subníveis s, p e d
-
nível N (4ª camada): subníveis s, p, d e f
-
nível O (5ª camada): subníveis s, p, d e f
-
nível P (6ª camada): subníveis s, p e d
-
nível Q (1ª camada): subníveis s e p
Cada um dos subníveis comporta um número diferente de elétrons. Veja:
-
subnível s comporta, no máximo, 2 elétrons;
-
subnível p comporta, no máximo, 6 elétrons;
-
subnível d comporta, no máximo, 10 elétrons;
-
subnível f comporta, no máximo, 14 elétrons.
Dessa forma, se a camada de valência de certo átomo é a M, a quantidade de elétrons máxima que pode estar presente nela são 18 (2 elétrons do subnível s + 6 elétrons do subnível p + 10 elétrons do subnível d).
Para determinar a camada de valência de um átomo e quantos elétrons ela apresenta, existem duas formas, a saber:
→ Determinação da camada de valência e do seu número de elétrons a partir de distribuição eletrônica
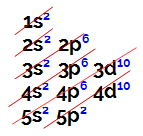
As distribuições eletrônicas sempre são realizadas por intermédio do diagrama de Linus Pauling, representado a seguir:

Representação de um diagrama de Linus Pauling
Com um número atômico (que indica o número de elétrons de um átomo), fazemos a distribuição eletrônica. Por exemplo, um átomo de número atômico 50:
Distribuição eletrônica do átomo de número atômico igual a 50
Analisando a distribuição acima, temos que o nível mais distante do núcleo é o 5º (nível N), no qual temos a presença de 4 elétrons (dois no subnível s e 2 no subnível p).
→ Determinação da camada de valência e do seu número de elétrons a partir da Tabela Periódica
A tabela é disposta em períodos (colunas horizontais), que indicam o número de níveis de um átomo, e grupos ou famílias (colunas verticais). O período é utilizado para a determinação da camada de valência, e as famílias são utilizadas para a determinação do número de elétrons.
a) Conhecendo o período do elemento químico
A Tabela Periódica apresenta um total de sete períodos, número esse que está relacionado com o número de níveis presentes no diagrama de Linus Pauling. Assim, se conhecemos o período em que o elemento químico encontra-se na tabela, automaticamente, sabemos quantos níveis os seus átomos possuem, sendo a camada de valência o nível mais distante do núcleo.
1º Exemplo: Elemento químico Potássio
O Potássio está posicionado no quarto período da Tabela Periódica, logo, o seu átomo apresenta quatro níveis, sendo o quarto nível a camada de valência, o que é confirmado por meio de sua distribuição eletrônica.
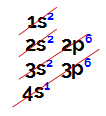
Distribuição eletrônica do elemento potássio
2º Exemplo: Elemento químico Flúor
O flúor está posicionado no segundo período da Tabela Periódica, logo, o seu átomo apresenta dois níveis, sendo o segundo nível a camada de valência, o que é confirmado por meio de sua distribuição eletrônica.

Distribuição eletrônica do elemento flúor
3º Exemplo: Elemento químico Índio
O Índio está posicionado no quinto período da Tabela Periódica, logo, o seu átomo apresenta cinco níveis, sendo o quinto nível a camada de valência, o que é confirmado por meio de sua distribuição eletrônica.

Distribuição eletrônica do elemento Índio
b) Conhecendo a família ou grupo do elemento químico
Conhecendo a família ou grupo no qual o elemento está posicionado, sabemos também o número de elétrons presentes na camada de valência desse elemento.
-
Elementos da família A
Os elementos das famílias A estão posicionados nas colunas de número 1, 2, 13 a 18 da Tabela Periódica. Cada uma dessas colunas recebe um número (de 1 a 8, algarismo romano), o qual indica exatamente o número de elétrons da camada de valência desses elementos:
-
Coluna 1 - família IA = todos possuem 1 elétron na camada de valência;
-
Coluna 2 - família IIA = todos possuem 2 elétrons na camada de valência;
-
Coluna 3 - família IIIA = todos possuem 3 elétrons na camada de valência;
-
Coluna 4 - família IVA = todos possuem 4 elétrons na camada de valência;
-
Coluna 5 - família VA = todos possuem 5 elétrons na camada de valência;
-
Coluna 6 - família VIA = todos possuem 6 elétrons na camada de valência;
-
Coluna 7 - família VIIA = todos possuem 7 elétrons na camada de valência;
-
Coluna 8 - família VIIIA = todos possuem 8 elétrons na camada de valência.
Veja alguns exemplos da determinação do número de elétrons de valência de alguns elementos de família A:
Exemplo 1: Elemento químico Bário
O Bário está localizado na família IIA, logo, apresenta dois elétrons na camada de valência, o que é confirmado por sua distribuição eletrônica:

Distribuição eletrônica do elemento Bário
Exemplo 2: Elemento químico Antimônio
O Antimônio está localizado na família VA, logo, apresenta cinco elétrons na camada de valência, o que é confirmado por sua distribuição eletrônica:

Distribuição eletrônica do elemento antimônio
Exemplo 3: Elemento químico Xenônio
O Xenônio está localizado na família VIIIA, logo, apresenta oito elétrons na camada de valência, o que é confirmado por sua distribuição eletrônica.

Distribuição eletrônica do elemento Xenônio
OBS.: o único elemento químico pertencente à família A que foge à regra proposta é o Hélio. Ele pertence à família VIIIA, mas apresenta apenas dois elétrons na camada de valência. Isso porque seu número atômico é 2, logo, é impossível que ele apresente 8 elétrons na camada de valência como os outros elementos da família.
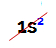
Distribuição eletrônica de um átomo de hélio
-
Elementos de família B
Os elementos das famílias B estão posicionados nas colunas de número 3 a 12 da Tabela Periódica. Assim como as famílias A, existem também oito famílias B, as quais são representadas por algarismos romanos. Diferentemente das famílias A, o número da família B não determina a quantidade de elétrons na camada de valência.
O número de elétrons na camada de valência de um elemento da família B é sempre igual a 2, independentemente do número atômico e do posicionamento na tabela. As distribuições eletrônicas do califórnio (98Cf) e hássio (108Hs) comprovam isso:
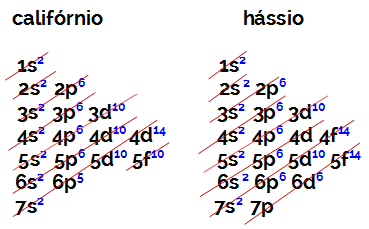
A distribuição eletrônica do califórnio apresenta como subnível mais energético o 5f10, e a o do hássio é 6d6. Em ambos os casos, o subnível mais distante do núcleo é o sétimo nível e ambos apresentam dois elétrons distribuídos.
Por Me. Diogo Lopes Dias
