As moléculas das substâncias não são todas retas, como se estivessem em um único plano. Afinal de contas, elas estão espalhadas no espaço e seus átomos adquirem arranjos ou disposições diferentes. Assim, existem formas geométricas variadas para as moléculas de cada tipo de substância.
Uma das formas mais simples de se determinar a geometria de uma molécula é com base na teoria de repulsão dos pares de elétrons da camada de valência (RPECV). Segundo essa teoria, os pares de elétrons do átomo central funcionam como nuvens eletrônicas que se repelem mutuamente. Desse modo, elas ficam orientadas na maior distância possível umas das outras. A geometria molecular dependerá da quantidade de pares eletrônicos ao redor do átomo central.
Essa nuvem eletrônica pode ser de elétrons que participam de ligações (simples, duplas ou triplas) e também que não participam. Assim, temos:
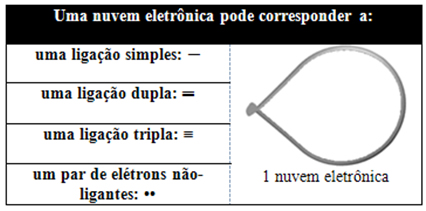
Ajuda pensar nessa nuvem como se fosse uma bexiga ou bexigas amarradas, sendo que o átomo central fica no centro delas. Por exemplo, em uma molécula que possui apenas duas nuvens eletrônicas ao redor do átomo central, a maior distância possível entre elas é um ângulo de 180º e, consequentemente, a geometria da molécula será linear.
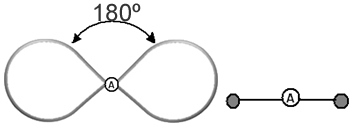
Portanto, podemos fazer uma dedução sobre como será a geometria molecular de grande parte das moléculas se levarmos em consideração a quantidade de átomos existentes nas moléculas, e as ligações que o átomo central realiza, verificando se ele possui ou não pares de elétrons.
Veja os exemplos a seguir:
- Moléculas com 2 átomos: sempre será linear
Por exemplo:
H ─ H, H ─ Cl, F ─ F, O ═ O, C ≡ O.
- Molécula com 3 átomos: angular ou trigonal
Se o átomo central possuir um par de elétrons não ligantes a geometria será angular, como ocorre no caso da molécula de SO2:
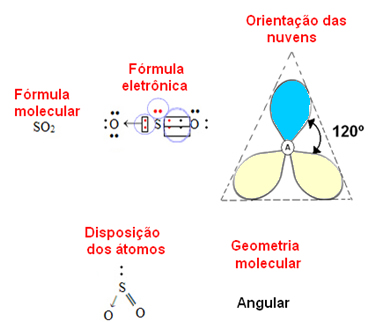
Considere a nuvem eletrônica azul como representando pares de elétrons que não participam das ligações, e a amarela como sendo pares de elétrons que participam das ligações.
- Molécula com 4 átomos: trigonal plana (ou triangular) ou piramidal (ou pirâmide trigonal)
Se o átomo central não possuir par de elétrons desemparelhados (não ligantes) a geometria molecular é trigonal plana (ou triangular). Observe o exemplo do BF3:
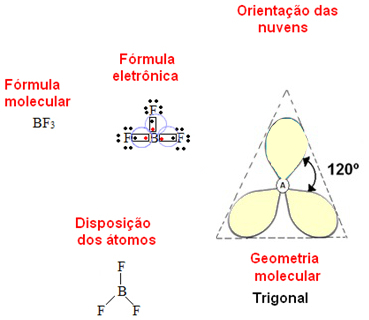
Se o átomo possuir pares de elétrons não ligantes, a geometria da molécula será piramidal (ou pirâmide trigonal), como no caso da amônia:
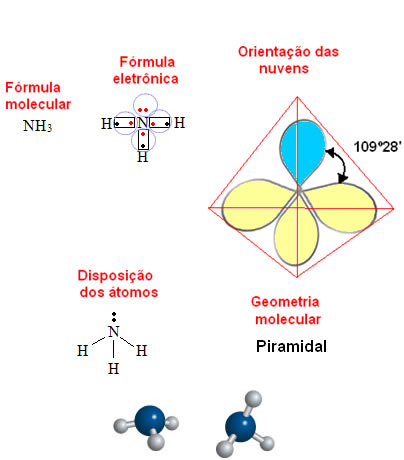
- Molécula com 5 átomos: tetraédrica
Exemplo da geometria do metano:
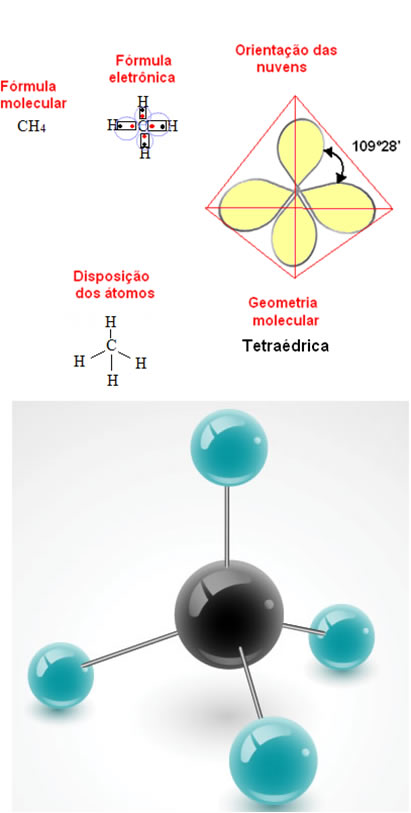
- Molécula com 6 átomos: bipirâmide trigonal ou pirâmide triangular.
Um exemplo é o pentacloreto de fósforo (PCl5), que possui algumas ligações entre o fósforo e o cloro num ângulo de 90º e outras de 120º, formando uma bipirâmide de base triangular:
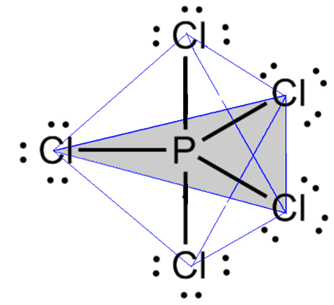
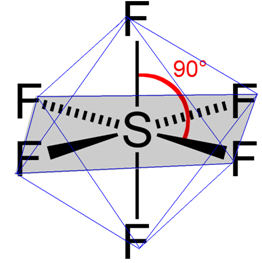
- Molécula com 7 átomos: octaédrica
Exemplo: hexafluoreto de enxofre (SF6), cujos ângulos são de 90º.
Por Jennifer Fogaça
Graduada em Química