A ligação covalente ocorre quando dois átomos compartilham pares de elétrons a fim de adquirirem a configuração eletrônica de um gás nobre (com 8 elétrons na camada de valência ou com 2, no caso dos que apresentam apenas a camada K), segundo a regra do octeto.
Porém, existem casos especiais de ligações covalentes em que o par de elétrons compartilhados é proveniente apenas de um dos átomos que já está estável. Antigamente, esse tipo de ligação covalente era chamado de dativa, hoje ela é mais comumente denominada de coordenada.
Veja alguns exemplos para entender como isso ocorre:
- CO (monóxido de carbono):
O carbono possui 4 elétrons na sua camada de valência. Portanto, segundo a regra do octeto, para ficar estável, ele precisa receber mais 4 elétrons, totalizando os 8. Já o oxigênio possui 6 elétrons na camada de valência e precisa receber 2 elétrons para ficar com a configuração do gás nobre neônio.
Assim, primeiramente o carbono e o oxigênio compartilham dois pares de elétrons para que o oxigênio fique estável:
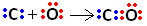
No entanto, o carbono permanece instável, pois ele ainda possui 6 elétrons e precisa de mais 2. Por isso, o oxigênio, que já está estável, compartilha um de seus pares de elétrons com o carbono, isto é, realiza uma ligação dativa com ele, tornando-o estável:
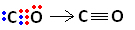
Veja que a ligação covalente coordenada pode ser representada por um traço, assim como a ligação covalente comum.
- SO2 (Dióxido de enxofre):
Cada átomo de enxofre e de oxigênio possuem 6 elétrons em suas camadas de valências, assim, eles precisam receber 2 elétrons cada um. Inicialmente, o enxofre realiza duas ligações covalentes comuns, compartilhando dois pares de elétrons com um dos átomos de oxigênio, ficando ambos estáveis com 8 elétrons.
Mas, o outro átomo de oxigênio não está estável, por isso, o enxofre compartilha um par de seus elétrons com ele por meio de uma ligação covalente coordenada ou dativa:
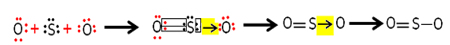
Veja que nesse caso temos três átomos na molécula, podendo, então, haver a migração da ligação de um átomo para o outro. A molécula de dióxido de enxofre também pode ser representada assim: O ─ S ═ O.
Chamamos esse fenômeno da ligação de ressonância. Veja mais três exemplos no quadro abaixo:
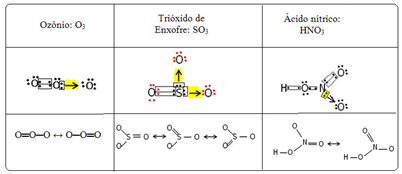
As estruturas possíveis são chamadas de estruturas de ressonância ou formas canônicas.
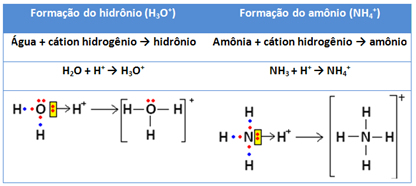
Esse tipo de ligação ocorre também na formação de íons, como é o caso dos íons hidrônio (H3O+) e do amônio (NH4+).
Primeiramente, o cátion H+ se forma quando o hidrogênio perde seu único elétron, ficando com a carga positiva. Assim, ele precisará receber dois elétrons para ficar estável. Isso acontece por meio de uma ligação dativa com a água (no caso do íon hidrônio) e com a amônia (no caso do íon amônio). Observe:
Por Jennifer Fogaça
Graduada em Química