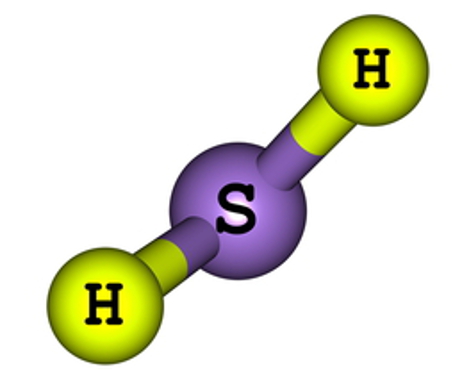
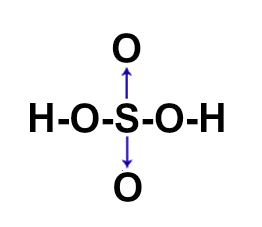
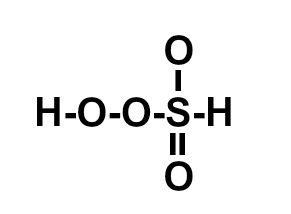
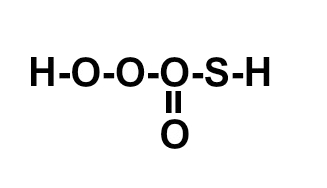
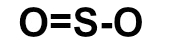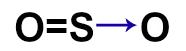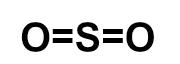Os compostos moleculares, ou covalentes, são formados por meio de ligações covalentes, aquelas nas quais não temos o envolvimento de metais (com exceção do Berílio) em sua formação. Assim, nesse tipo de ligação, todos os átomos precisam receber elétrons e, por isso, sempre os compartilharão.
A fórmula estrutural é uma das formas utilizadas para representar o compartilhamento de elétrons entre os átomos dos compostos moleculares. Para que consigamos realizar a montagem de uma fórmula estrutural, é necessário que antes de mais nada saibamos qual é a necessidade de cada um dos elementos envolvidos no composto de acordo com a teoria do octeto. A tabela a seguir mostra a necessidade de cada elemento envolvido de acordo com sua família:
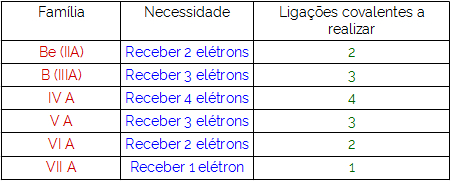
A partir das necessidades expressas acima, devemos saber que, ao montar uma fórmula estrutural, temos como recursos apenas as seguintes ferramentas:
• ligação simples: − (compartilhamento de dois elétrons);
• ligação dupla: = (compartilhamento de quatro elétrons);
• ligação tripla: ≡ (compartilhamento de seis elétrons);
Conhecendo as necessidades e as ferramentas, a montagem da fórmula estrutural de um composto molecular pode ser realizada a partir do seguinte passo a passo:
a) Molécula diatômica (formada por apenas dois átomos):
Basta escrever um átomo à esquerda e um átomo à direita e colocar a ligação que se adéqua as necessidades de ambos. Veja alguns exemplos:
- O2
Como o oxigênio pertence à família VIA, ele necessita de dois elétrons. Por isso, a ligação que melhor se enquadra entre eles é a ligação dupla.
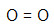
- HCl
Como o H e o Cl necessitam apenas de um elétron, a ligação que melhor se enquadra entre eles é a simples.
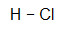
b) Moléculas que apresentam mais de dois átomos
Em compostos moleculares que apresentam mais de dois átomos, devemos posicionar no centro da molécula o átomo que necessita de um maior número de ligações (prioridade) ou o átomo menos eletronegativo. Os demais devem ficar nos quatro polos (norte, sul, leste e oeste). Na hora de colocar a ligação entre cada um deles, devemos priorizar os átomos que estão nos polos. O átomo central sempre vai ser estabilizado seguindo essa ordem de montagem. Veja alguns exemplos:
- H2O
Como o oxigênio necessita de mais ligações (duas, por ser da família VIA), ele será colocado no centro da molécula, e os hidrogênios, nos polos. Como a necessidade de cada H é de apenas uma ligação para cada um deles, utilizaremos uma ligação simples. Como o oxigênio realizará duas ligações simples, ele estará estável.
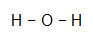
- NH3
Como o nitrogênio necessita de mais ligações (três, por ser da família VA), ele será colocado no centro da molécula, e os hidrogênios, nos polos. Como a necessidade de cada hidrogênio é de apenas uma ligação para cada um deles, utilizaremos uma ligação simples. Como o oxigênio realizará três ligações simples, ele estará estável.
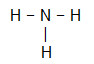
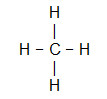
- CH4
Como o carbono necessita de mais ligações (quatro, por ser da família VIA), ele será colocado no centro da molécula, e os hidrogênios, nos polos. Como a necessidade de cada hidrogênio é de apenas uma ligação para cada um deles, utilizaremos uma ligação simples. Como o carbono realizará quatro ligações simples, ele estará estável.
- CO2
Como o carbono necessita de mais ligações (4, por ser da família IVA), ele será colocado no centro da molécula, e os oxigênios, nos polos. Como a necessidade de cada O é de duas ligações para cada um deles, utilizaremos uma ligação dupla. Como o oxigênio realizará duas ligações duplas, ele estará estável.
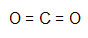
Observação: Quando um átomo da molécula, durante a montagem da fórmula estrutural, estiver estável e outro ainda necessitar de dois elétrons, podemos utilizar uma ferramenta diferenciada, que é a chamada ligação covalente coordenada dativa. Esse tipo de ligação só pode utilizado mediante essa condição (um átomo estável e outro necessitando de dois elétrons). Veja alguns exemplos:
- CO
Como só temos dois átomos, vamos posicionar um à esquerda e outro à direita. O oxigênio precisa de duas ligações, por isso, temos que utilizar obrigatoriamente uma ligação dupla.
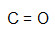
Porém, ao utilizar a dupla, o oxigênio fica estável e o carbono ainda precisa de mais dois elétrons. Por isso, podemos utilizar a ligação covalente dativa, que é representada por uma seta que sempre vai do átomo estável até o átomo que não está estável.
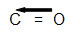
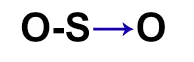
- O3
Como temos três átomos, um dos oxigênios deverá ficar no centro da molécula e os outros dois, nos polos. A regra estudada sempre pede para que, nesses casos, coloquemos primeiramente ligações nos átomos dos polos. Todavia, aqui só podemos adicionar uma única dupla, já que todos os oxigênios só fazem duas ligações.
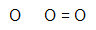
O oxigênio do centro está estável, enquanto o da esquerda necessita ainda de dois elétrons. Por essa razão, podemos utilizar uma ligação dativa para estabilizá-lo.
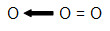
Por Me. Diogo Lopes Dias