A hibridização é um fenômeno associado à formação de orbitais atômicos híbridos, a partir da combinação de, pelo menos, dois orbitais atômicos. A hibridização é um efeito estabilizante que átomos realizam durante o processo de formação de ligações covalentes. Os orbitais atômicos híbridos gerados apresentam as propriedades dos orbitais de origem, em proporções variadas.
A hibridização é, em geral, atrelada ao átomo de carbono, que, por conta da versatilidade de ligações covalentes em compostos orgânicos, pode adotar até três tipos de hibridização (sp3, sp2 e sp) envolvendo os orbitais atômicos dos subníveis de valência 2s e 2p. A hibridização é fundamental para entender a formação das moléculas, bem como sua geometria.
Leia também: O que é camada de valência?
Tópicos deste artigo
- 1 - Resumo sobre hibridização
- 2 - O que é hibridização?
- 3 - Tipos de hibridização
- 4 - Hibridização do carbono
- 5 - Como saber qual tipo de hibridização?
- 6 - Exercícios resolvidos sobre hibridização
Resumo sobre hibridização
- A hibridização é um fenômeno da Química em que dois ou mais orbitais atômicos se misturam para a formação de um novo orbital, chamado de híbrido.
- O orbital híbrido gerado carrega as propriedades, nas devidas proporções, dos seus orbitais atômicos de origem.
- É por meio da hibridização de orbitais atômicos que podemos entender as geometrias moleculares e a formação das moléculas.
- O carbono chama a atenção, pois, em compostos orgânicos, pode apresentar três tipos distintos de hibridização.
- O carbono pode ter hibridização sp3, sp2 ou sp a depender da quantidade de ligações covalentes simples, duplas ou triplas a serem realizadas.
O que é hibridização?
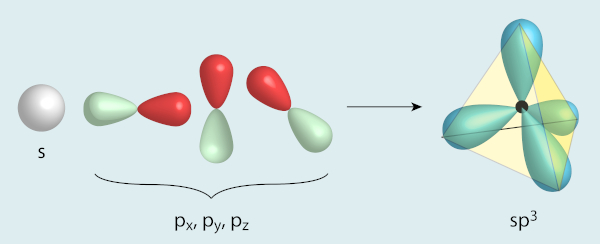
A hibridização é o fenômeno associado à formação de orbitais híbridos, ou seja, a combinação de, pelo menos, dois orbitais atômicos. Como resultado, surgem novos orbitais, os quais possuem, em proporções variadas, as propriedades dos orbitais originais considerados separadamente. Isso traz ganhos de estabilidade importantes para a molécula.
O modelo de hibridização é muito empregado para explicar a formação das ligações covalentes em moléculas, bem como suas geometrias, seja em compostos orgânicos, seja em compostos inorgânicos, com destaque para BeH2, BF3, PCl5 e SF6.
Tipos de hibridização
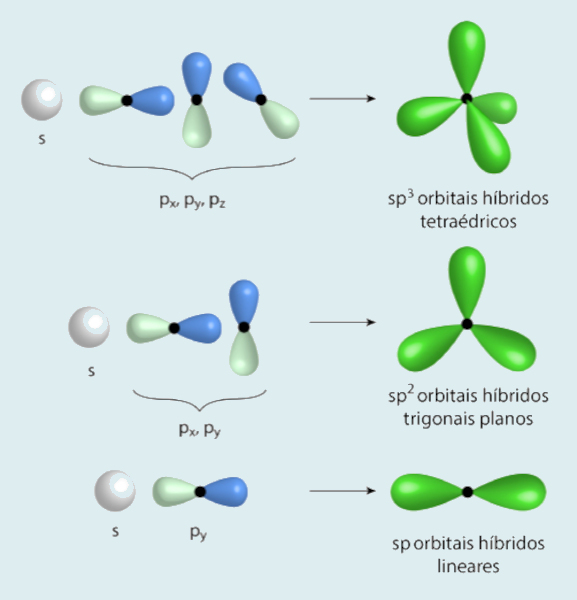
Os tipos de hibridização são:
- sp: formado pela combinação de um orbital s e um orbital p;
- sp2: formado pela combinação de um orbital s e dois orbitais p;
- sp3: formado pela combinação de um orbital s e três orbitais p;
- sp3d: formado pela combinação de um orbital s, três orbitais p e um orbital d;
- sp3d2: formado pela combinação de um orbital s, três orbitais p e dois orbitais d.
Hibridização do carbono
O carbono é um átomo que apresenta quatro elétrons na sua camada de valência, conforme distribuição eletrônica (1s2 2s2 2p2). Sendo assim, para atingir o octeto, o carbono deve realizar quatro ligações covalentes. Por isso, os elétrons disponíveis nos subníveis s e p da camada de valência do carbono (camada 2) devem estar disponíveis para realizar tais ligações covalentes.
Num entendimento simples sobre formação de ligações covalentes e mecânica quântica, entendemos que os subníveis são, na verdade, orbitais atômicos, regiões de existência de elétrons. Cada orbital atômico pode comportar até dois elétrons. Dessa forma, o subnível s é composto por um único orbital atômico, enquanto o subnível p é composto por três orbitais atômicos (por isso que o subnível p suporta até seis elétrons na distribuição eletrônica).
Ao observar o diagrama de Pauling, percebemos que o orbital do subnível 2s possui uma menor energia que os orbitais do subnível 2p. Portanto, o orbital atômico do subnível 2s é preenchido primeiramente com dois elétrons.
Os outros dois elétrons, dessa forma, são alocados dentro dos orbitais atômicos do subnível 2p. A seguir, representa-se um modelo da apresentação da camada de valência de carbono, no qual as setas representam os carbonos. Os orbitais atômicos são os pequenos degraus. Repare que os do subnível 2p estão um pouco acima do subnível 2s, indicando que possuem maior energia.
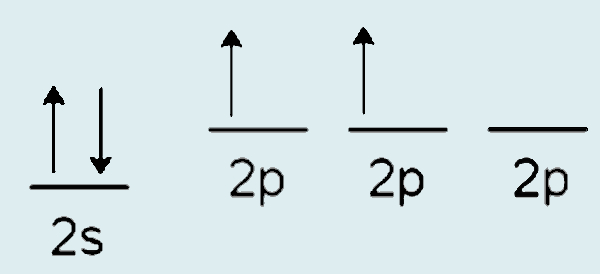
Os elétrons do subnível 2s são representados por meio de setas com direções opostas. Isso é feito para indicar que os elétrons do orbital apresentam movimento spin contrário, que seria um movimento giratório do elétron em seu próprio eixo. Apresentar spin contrário garante uma maior estabilidade para os elétrons dentro do orbital atômico, segundo a mecânica quântica.
Como temos quatro elétrons de valência, os dois primeiros elétrons irão ocupar o orbital de menor energia, porém com spin contrário. Os outros dois elétrons remanescentes irão se apresentar nos orbitais atômicos do subnível 2p, porém em orbitais distintos, já que isso minimiza a repulsão eletrônica e também garante maior estabilidade.
Os elétrons do subnível 2p são chamados de elétrons desemparelhados. Orbitais parcialmente preenchidos são aqueles que estão disponíveis para realização de ligações covalentes (uma vez que a ligação covalente é formada por meio do compartilhamento dos orbitais atômicos de valência).
Como a ligação química garante uma maior estabilidade, o carbono promove um dos seus elétrons para o orbital vazio do subnível 2p. Isso é um efeito chamado de “excitação do elétron” e, embora envolva ganho de energia, o carbono, ao realizar as ligações, acabará liberando muito mais energia, apresentando um saldo energético favorável em termos de estabilidade (como naquele ditado popular de “dar um passo para trás para depois dar dois passos para frente”).
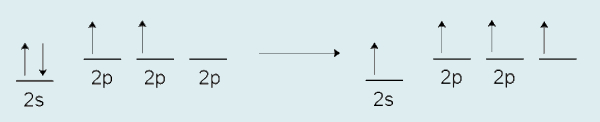
Agora o carbono apresenta quatro elétrons desemparelhados, o que indica que ele está disponível para realizar quatro ligações covalentes.
Porém, ao avaliarmos a molécula de metano, CH4, em que o carbono realiza quatro ligações simples, dados experimentais deixam claro que as quatro ligações são idênticas. Como essas ligações seriam idênticas se o orbital atômico do subnível 2s é de menor energia que os orbitais atômicos do subnível 2p? Sendo assim, uma ligação covalente seria diferente.
Na verdade, essas quatro ligações covalentes são iguais porque o carbono forma orbitais atômicos híbridos por meio da junção do orbital atômico do subnível 2s com os três orbitais atômicos do subnível 2p, formando quatro orbitais atômicos de mesma energia (chamados de orbitais degenerados), denominados de sp3, já que foram feitos por um orbital atômico s e três orbitais atômicos p.

A hibridização também garante maior estabilidade, pois, por mais que o orbital atômico do subnível 2s apresente um ganho de energia, os três orbitais atômicos do subnível 2p vão para um nível de menor energia, justificando energeticamente a formação do orbital híbrido.
Agora, o carbono apresenta quatro orbitais atômicos com elétrons desemparelhados, para a formação de quatro ligações covalentes simples, explicando adequadamente a formação do metano, CH4, além de outros alcanos, como etano, propano, butano, etc.
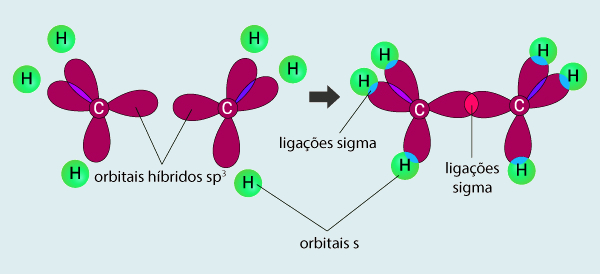
Essa é conhecida como hibridização sp3 do átomo de carbono, que dá origem à possibilidade de quatro ligações covalentes simples, as quais serão chamadas de ligações sigma (σ). As quatro ligações covalentes deverão apresentar a maior distância angular possível (a fim de minimizar efeitos de repulsão eletrônica) e, por isso, adotam um arranjo tetraédrico (distância angular de 109,5°).
No caso de eteno, um alceno, vê-se uma ligação covalente dupla entre os átomos de carbono.
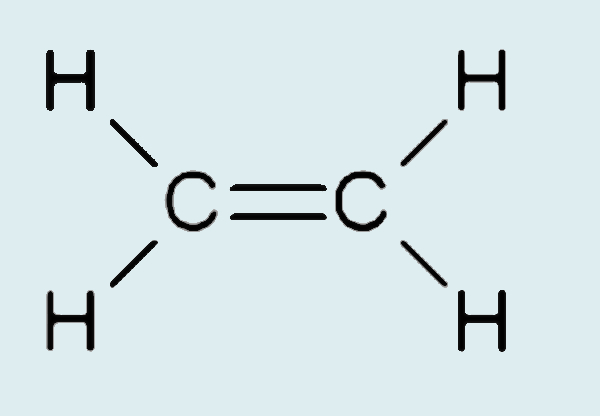
Por mais que os carbonos realizem quatro ligações, cada um deles só está ligado a outros três átomos (um átomo de carbono e mais dois átomos de hidrogênio). Para se ligar, portanto, a três átomos, o carbono, ao invés de hibridizar quatro orbitais atômicos, hibridiza apenas três, formando o chamado orbital híbrido sp² (formado por um orbital atômico s e dois orbitais atômicos p).
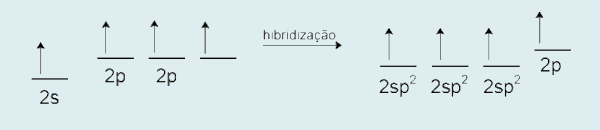
Assim, entende-se a formação das três ligações sigma de cada átomo de carbono do eteno: duas ligações C−H e uma ligação C−C. A segunda ligação entre os átomos de carbono não é formada pela combinação dos orbitais atômicos híbridos 2sp2. Ela é formada, na verdade, pela combinação dos orbitais atômicos 2p de ambos os átomos de carbono que não participaram da formação do orbital híbrido.
Essa ligação é, portanto, diferente da ligação sigma, sendo um pouco mais fraca. Essa ligação é chamada de ligação pi (π). Portanto, na ligação C=C, uma ligação é sigma (2sp2−2sp2), enquanto a outra ligação é pi (2p−2p).
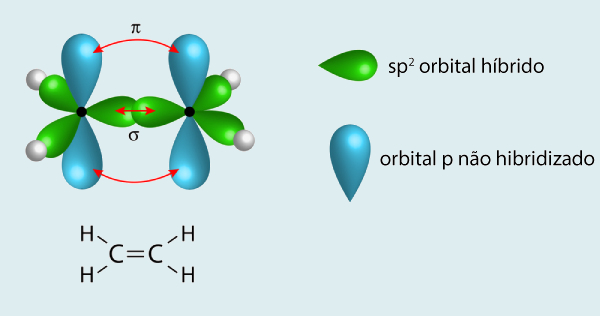
Na imagem, em verde, estão os orbitais atômicos híbridos sp2, os quais formam uma geometria trigonal plana em cada carbono (pontos pretos). Em azul mais claro, está o orbital p que não participou da formação do orbital híbrido, sendo este utilizado para a formação da ligação pi.
Na hibridização sp2, como são formados três orbitais atômicos novos, estes acabarão ficando em um plano (três pontos não colineares formam um plano), com uma distância angular máxima de 120°. Por isso, os átomos de carbono que realizam hibridização sp2 apresentam um arranjo geométrico trigonal plano para suas ligações sigma.
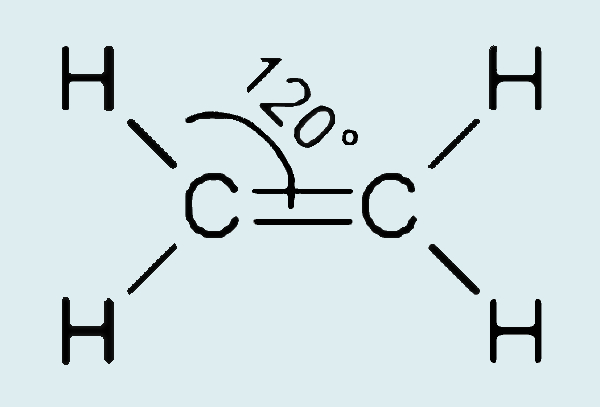
De modo análogo, na formação do etino, por exemplo, o carbono se liga a apenas dois átomos: ao hidrogênio e a outro átomo de carbono. Por isso, se serão realizadas duas ligações covalentes por parte do carbono, será necessária a hibridização de apenas dois orbitais atômicos (um orbital s e um orbital p), dando origem aos orbitais atômicos híbridos sp.

Portanto, haverá a formação de duas ligações sigma: a ligação C−H e a ligação C−C. A segunda e a terceira ligação entre os átomos de carbono ocorrerão por intermédio dos orbitais atômicos 2p, não participantes do orbital híbrido. Como no caso do eteno, esses orbitais, diferentes e de maior energia, formarão as ligações covalente do tipo pi, as quais são mais fracas. Na ligação C≡C, o carbono realiza uma ligação sigma e duas ligações pi.
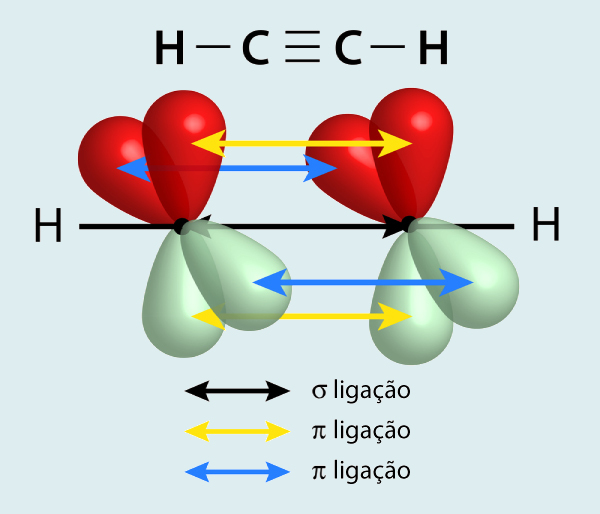
Na imagem, veja que os átomos de carbono e hidrogênio estão na mesma linha da ligação sigma, caracterizando a geometria linear. As ligações pi são formadas pelos dois orbitais p que não se hibridizam.
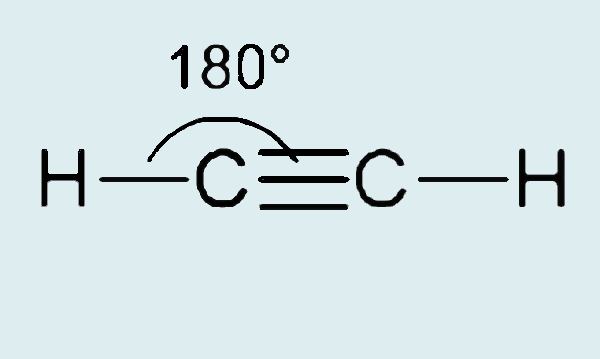
Na hibridização sp, como há apenas dois orbitais atômicos, estes formam um arranjo linear e, por conta disso, a distância angular no arranjo H−C−C é de 180°.
Nos alcadienos vicinais (ou acumulados), em que as duas ligações duplas são consecutivas (ou seja, um átomo de carbono realiza duas ligações duplas), como é o caso do propadieno, a hibridização adotada pelo carbono que faz as duas ligações duplas também será do tipo sp, com distância angular de 180° entre as ligações sigma.
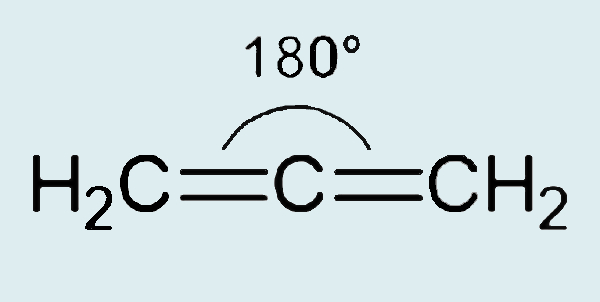
Assim como no etino, o carbono central do propadieno também deve se ligar a dois átomos, apenas: os dois outros átomos de carbono. Dessa forma, também utilizará dois orbitais atômicos para hibridização, formando os orbitais híbridos sp para formação das ligações sigma C−C. A segunda ligação ocorrerá com os orbitais atômicos 2p que não participaram da hibridização, formando as ligações pi.
Leia também: Como ocorre a hibridização do fósforo
Como saber qual tipo de hibridização?
No caso do carbono, elemento que, dada a versatilidade de ligações covalentes, pode ter diversas hibridizações, o tipo de hibridização pode ser identificado por meio de dois parâmetros: pelo tipo de ligação covalente ou pela geometria molecular.
Assim, no auxílio da identificação do tipo de hibridização do átomo de carbono, temos a seguinte tabela.
|
Hibridização |
Ligações sigma |
Ligações pi |
Tipo de ligação |
Geometria |
|
sp3 |
4 |
0 |
Quatro ligações simples |
Tetraédrica |
|
sp2 |
3 |
1 |
Uma ligação dupla e duas ligações simples |
Trigonal plana |
|
sp |
2 |
2 |
Uma ligação tripla e uma ligação simples OU duas ligações duplas |
Linear |
Exercícios resolvidos sobre hibridização
Questão 1. (UFAM PSC 3ª Etapa/2023) Considere a fórmula estrutural do hidrocarboneto a seguir:
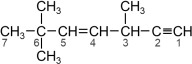
A sequência CORRETA para os estados de hibridização dos carbonos 2, 3, 5 e 6, indicados na figura, é:
A) sp, sp3, sp2 e sp3.
B) sp, sp2, sp3 e sp2.
C) sp3, sp2, sp2 e sp.
D) sp, sp2, sp2 e sp3.
E) sp, sp3, sp3 e sp2.
Resposta: Letra A.
Carbono 2: 1 ligação tripla e 1 ligação simples, portanto hibridização sp.
Carbono 3: 4 ligações simples, portanto hibridização sp3.
Carbono 5: 1 ligação dupla e 2 ligações simples, portanto hibridização sp2.
Carbono 6: 4 ligações simples, portanto hibridização sp3.
Questão 2. (UEA – Específica Biológicas/2023) A região amazônica é rica em biodiversidade. Uma das árvores frutíferas dessa região brasileira é o camucamuzeiro (Myrciaria dubia), cujo fruto, que pode ser chamado camu-camu, caçari ou araçá-d’água, é extremamente rico em vitamina C. A fórmula estrutural da vitamina C é:
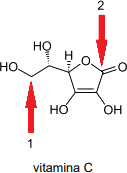
Os tipos de hibridização dos orbitais do átomo de carbono indicado na fórmula estrutural da vitamina C pela seta vermelha 1 e pela seta vermelha 2 são, respectivamente:
A) sp e sp2
B) sp3 e sp
C) sp2 e sp
D) sp3 e sp2
E) sp2 e sp3
Resposta: Letra D.
Seta 1: carbono de hibridização sp³, pois apresenta apenas 4 ligações simples (duas ligações com hidrogênio estão ocultas, visto que é fórmula em bastão).
Seta 2: carbono de hibridização sp², pois apresenta 1 ligação dupla e duas ligações simples.
Fontes
INTERNATIONAL UNION OF PURE AND APPLIED CHEMISTRY – IUPAC. Glossary of terms used in physical organic chemistry. Pure and Applied Chemistry, Reino Unido, v. 66, n. 5, p. 1077-1184, 1994.
SOLOMONS, T. W. G.; FRYHLE, C. B.; SNYDER, S. A. Química Orgânica: volumes 1 e 2. 12. ed. Rio de Janeiro: LTC, 2018.
BRUICE, P. Y. Organic Chemistry. 8. ed. Upper Saddle River, Nova Jersey: Pearson Education Inc., 2015.






