As propriedades coligativas são propriedades de uma solução que possuem relação apenas com a quantidade de soluto dissolvido, e não com sua natureza, ou seja, não importando se ele é de natureza iônica ou covalente. Tais propriedades estão intimamente ligadas à presença de solutos não voláteis, ou seja, solutos que não evaporam da solução com facilidade.
A tonoscopia, a ebulioscopia, a crioscopia e a osmose são as propriedades coligativas. As três primeiras têm relação com a pressão de vapor, enquanto a última tem a ver com o fluxo de solvente entre soluções. Tais propriedades apresentam grandes aplicações em nosso dia a dia, como no preparo ou conservação de alimentos.
Leia também: Equilíbrio químico — o estudo do comportamento e das características de reações reversíveis
Tópicos deste artigo
- 1 - Resumo sobre as propriedades coligativas
- 2 - Videoaula sobre propriedades coligativas
- 3 - O que são propriedades coligativas?
- 4 - Solução, soluto e solvente
- 5 - Quais são as propriedades coligativas?
- 6 - Propriedades coligativas no dia a dia
- 7 - Exercícios resolvidos sobre propriedades coligativas
Resumo sobre as propriedades coligativas
-
As propriedades coligativas são propriedades de uma solução que apenas têm relação com a quantidade de soluto dissolvido, não importando a natureza do soluto em si.
-
São consideradas propriedades coligativas a tonoscopia, a ebulioscopia, a crioscopia e a osmose.
-
A tonoscopia é a diminuição da pressão de vapor pela presença de um soluto não volátil.
-
A ebulioscopia e a crioscopia são o aumento da temperatura de ebulição e a queda da temperatura de congelamento, respectivamente, consequências diretas da presença do soluto não volátil na solução.
-
A osmose é o fluxo de solvente de um meio menos concentrado para um meio mais concentrado por intermédio de uma membrana semipermeável.
Videoaula sobre propriedades coligativas
O que são propriedades coligativas?
As propriedades coligativas são propriedades de uma solução que dependem da concentração do soluto, independentemente de ele ser molecular ou iônico.
Solução, soluto e solvente
Sendo propriedades atreladas à solução, é importante fazer a distinção entre termos importantes nesse caso. Quando uma substância dissolve uma ou mais substâncias e assim atingimos uma mistura homogênea, estamos diante de uma solução. A substância responsável por dissolver as demais substâncias é chamada de solvente, enquanto as substâncias que foram dissolvidas são chamadas de soluto. Uma vez dissolvido, o soluto pode estar na forma iônica ou molecular, não sendo detectado por nenhum instrumento óptico disponível.

Embora as propriedades coligativas aqui apresentadas versem sobre soluções líquidas, também existem soluções sólidas, como é o caso das ligas metálicas.
Saiba mais: Diferenças entre soluto e solvente
Quais são as propriedades coligativas?
Serão apresentadas quatro propriedades coligativas: a tonoscopia (diminuição da pressão de vapor), a ebulioscopia (aumento do ponto de ebulição), a crioscopia (diminuição do ponto de congelamento) e a osmose.
-
Tonoscopia
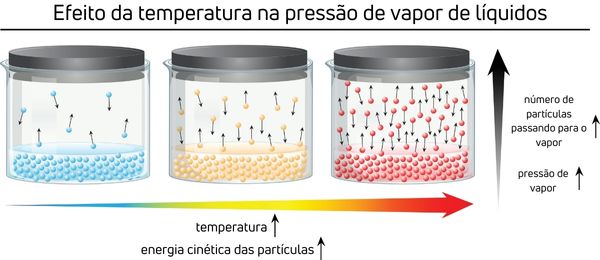
Mesmo abaixo da temperatura de ebulição, é possível que uma parte do líquido evapore, formando vapor sob sua superfície. Em um sistema fechado, esse vapor estabelece um equilíbrio dinâmico com a fase líquida da substância e, ao permanecer sobre a superfície, exerce pressão, já que possui massa. Essa pressão exercida por determinada quantidade de vapor é chamada de pressão de vapor.
Líquidos cuja interação intermolecular é fraca tendem a possuir maior pressão de vapor, visto que suas moléculas evaporam com mais facilidade. Quanto maior a pressão de vapor de um líquido, mais volátil ele é. A pressão de vapor é também diretamente proporcional à temperatura, pois quanto maior a temperatura, maior a energia cinética das moléculas, facilitando assim a sua evaporação (rompimento das interações intermoleculares). Veja o exemplo a seguir:
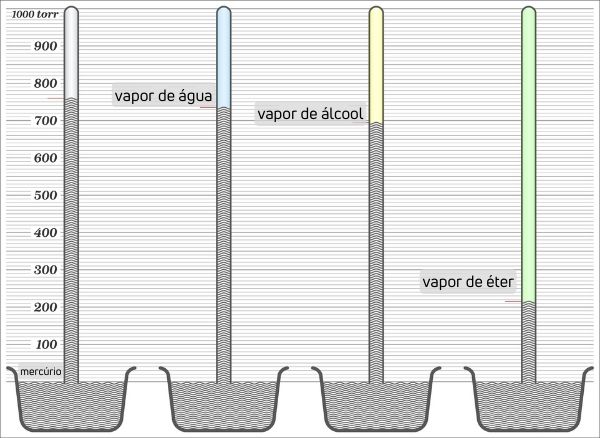
O mercúrio, no nível do mar, atinge uma altura de 76 cm em um tubo. Ao se adicionar substâncias no tubo, como água, álcool e éter, percebe-se uma diminuição da altura, por conta do aumento da pressão de vapor exercida. Quanto maior a queda da altura do mercúrio, maior a pressão de vapor.
Quando esse líquido forma uma solução por meio da dissolução de um soluto não volátil, ocorre o chamado efeito tonoscópico, que é a queda da pressão de vapor. Isso porque as moléculas do soluto bloqueiam o escape de moléculas do solvente da superfície da solução. Com menos moléculas na fase vapor, menos pressão será exercida.
-
Lei de Raoult
A queda da pressão de vapor de um líquido pode ser quantificada por meio de uma equação desenvolvida pelo cientista francês François-Marie Raoult, conhecida como lei de Raoult.
PA = xA ∙ PA*
PA é a pressão de vapor do líquido A, xA é a sua fração molar (varia de 0 a 1) e PA* é a pressão de vapor do líquido A quando puro.
Quando o líquido A deixa de ser puro e se torna um solvente em uma solução, a sua fração molar já não é de 100%, pois já não compõe mais a totalidade do sistema. Assim, quanto maior a presença de soluto, menor a fração molar do solvente (xA) e, consequentemente, menor a pressão de vapor.
-
Ebulioscopia
Uma das consequências da queda da pressão de vapor é o aumento da temperatura de ebulição. Isso porque um líquido atinge ebulição quando a pressão de vapor se iguala à pressão atmosférica.
Imagine um líquido puro em ebulição. Nesse ponto, a pressão de vapor é igual à pressão atmosférica. Agora, adiciona-se ao líquido um soluto não volátil, e, consequentemente, a pressão de vapor cai (a temperatura não). Para que a pressão de vapor se iguale novamente à pressão atmosférica, ela deve ser elevada. A elevação da pressão de vapor ocorre então com o aumento da temperatura, e, por conseguinte, a igualdade entre pressão de vapor e pressão atmosférica (ebulição) ocorrerá em uma temperatura maior do que quando o líquido estava puro.
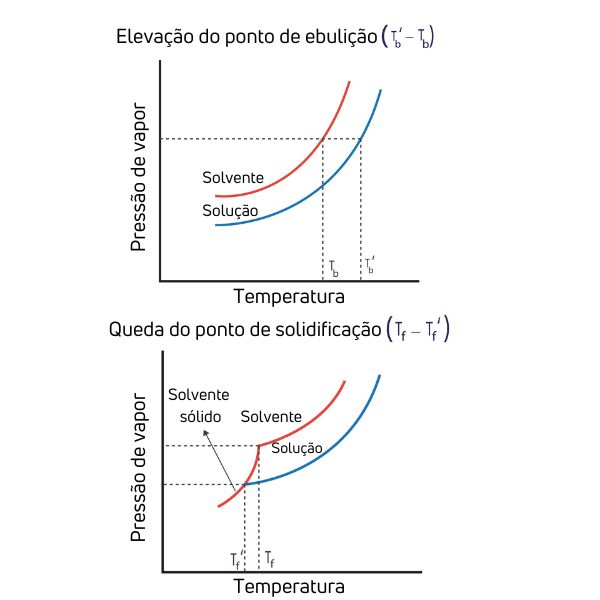
No caso da ebulioscopia, a queda da pressão de vapor (de vermelho para azul) faz com que a solução se iguale à pressão atmosférica em uma menor temperatura. Já no caso da crioscopia, a queda da pressão de vapor (de vermelho para azul) faz com que a solução se iguale à pressão de vapor do solvente sólido em uma menor temperatura.
-
Crioscopia (ou abaixamento crioscópico)
A queda da pressão de vapor também impacta o ponto de congelamento do líquido. Porém, dessa vez, ocasiona a diminuição da temperatura de solidificação do líquido.
Conforme diminuímos a temperatura de um líquido, suas moléculas se aproximam até que se inicie a solidificação. Os sólidos também possuem uma pressão de vapor, e quando a pressão de vapor do líquido se iguala à do sólido, ocorre a solidificação. E o que se percebe é que quando se parte de uma solução, essa igualdade ocorre em uma temperatura menor do que o ponto de congelamento caso o solvente estivesse puro.
Isso porque a pressão de vapor do sólido não se altera por conta de um soluto não volátil, já que se admite que o soluto não solidifica junto ao solvente, e apenas o solvente passa para a fase sólida. Entretanto, conforme o solvente vai congelando, mais concentrada de soluto fica a fase líquida, dificultando ainda mais o congelamento das moléculas de solvente restantes. Por isso, a temperatura deve cair para facilitar o congelamento, de modo que as moléculas do solvente possam se aproximar ainda mais.
Assim, quanto menor a pressão de vapor da solução, menor a temperatura de congelamento.
-
Osmose
É o fluxo de solvente através de uma membrana para uma solução mais concentrada. Tal membrana deve ser seletiva (semipermeável), de modo a permitir a passagem do solvente, mas não do soluto.
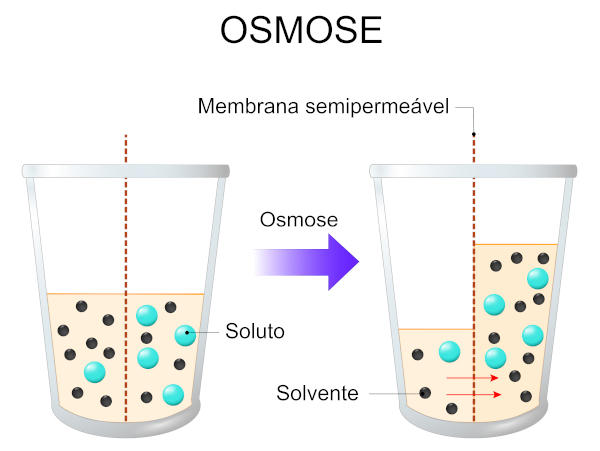
A passagem de solvente através da membrana faz com que haja um aumento na altura da parte que recebe o fluxo de solvente, havendo assim um aumento de pressão. Quando o fluxo de solvente cessa é porque a pressão é suficientemente alta para impedir esse trânsito.
A pressão capaz de cessar o fluxo de solvente é então chamada de pressão osmótica. Quanto maior for a pressão osmótica, maior deverá ser a altura da solução necessária para impedir o fluxo de solvente. Nesse ponto de fluxo nulo de solvente entre as soluções, é possível dizer que ambas estão isotônicas, ou seja, têm a mesma pressão osmótica.
Saiba mais: Como calcular a pressão osmótica
Propriedades coligativas no dia a dia
Diversas receitas exigem que aqueçamos a água até sua fervura, isto é, até a ebulição. É o caso, por exemplo, do preparo de massas, como o espaguete. Recomenda-se que após a fervura, adicione-se sal à água fervente. Perceba que após esse movimento, a fervura cessa imediatamente. Isso é consequência da queda de pressão de vapor causada pela adição de um soluto não volátil, o sal.
Veículos automotores, como carros, ônibus e caminhões, resfriam os seus motores por meio da água. Ocorre que a temperatura ideal de trabalho do motor é muito próxima da temperatura de ebulição de água, e por mais que o sistema seja, em condições ideais, selado, isso pode acarretar maior taxa de evaporação do líquido. Se o usuário do veículo não percebe essa queda no volume de água, ele corre o risco de causar superaquecimento no sistema, trazendo consequências significativas ao motor. Por isso, recomenda-se a utilização de uma solução refrigerante, que consiste em água e aditivo (etilenoglicol). Tal solução, com maior ponto de ebulição, diminui a taxa de fervura do líquido no nosso carro durante sua utilização.
Não é o caso do Brasil, mas nos países com inverno rigoroso, há o risco de a água do sistema de arrefecimento do veículo congelar. O aditivo também auxilia nesse caso, por meio do abaixamento crioscópico, pois diminui a temperatura de congelamento do líquido e assim dificulta que o líquido de arrefecimento se solidifique.

Ainda no cotidiano dos países que sofrem com invernos rigorosos, uma prática comum para desobstruir vias e pavimentos cobertos com gelo e neve é o ato de atirar sal, um soluto não volátil que fará com que a temperatura de congelamento da água diminua. Com a menor temperatura de congelamento (e, consequentemente, fusão), a neve será derretida mais rapidamente.

Embora nos dias atuais o ato de salgar carne seja atrelado a práticas culinárias, como no caso da produção de carne de sol, essa técnica foi também uma das primeiras formas de manter a carne livre de bactérias. Quando salgada, a carne desidrata por meio de osmose, eliminando bactérias nocivas e impedindo a sua proliferação. Essa prática era tão importante que os soldados romanos recebiam seus pagamentos (chamados de “soldo”) na forma de sal, dando origem à palavra “salário”.
Exercícios resolvidos sobre propriedades coligativas
Questão 1
(UFPR 2013) Em festas e churrascos em família, é costume usar geleiras de isopor para resfriar bebidas enlatadas ou engarrafadas. Para gelar eficientemente, muitas pessoas costumam adicionar sal e/ou álcool à mistura gelo/água. A melhor eficiência mencionada se deve ao fato de que a presença de sal ou álcool:
(A) aumenta a taxa de transferência de calor.
(B) abaixa a temperatura do gelo.
(C) aumenta a temperatura de ebulição.
(D) abaixa a temperatura de fusão.
(E) abaixa a dissipação de calor para o exterior.
Resposta: Letra D
A adição de sal, soluto não volátil, faz decair a pressão de vapor e, consequentemente, causa a queda da temperatura de fusão/congelamento do gelo. Isso permite, então, que o gelo congele em uma menor temperatura, aumentando a eficiência de resfriamento das bebidas.
Questão 2
(UCS-RS 2014) Flores recém-cortadas se mantêm viçosas quando seus caules estão imersos em água. Isso acontece porque a água, ao ser absorvida pelo caule, chega até as pétalas das flores, mantendo-as inturgescidas. Analogamente, frutas secas “incham” quando colocadas em água. Por outro lado, verduras cruas “murcham” mais rapidamente após serem temperadas com sal de cozinha. A propriedade coligativa que explica essas situações é estudada pela
(A) crioscopia.
(B) tonoscopia.
(C) termometria.
(D) ebuliometria.
(E) osmometria.
Resposta: Letra E
Quando existe uma diferença de concentração entre dois meios, há fluxo de solvente entre eles no sentido do menos concentrado para o mais concentrado. Assim, uma fruta seca, que é um meio mais concentrado, ao receber água (solvente), incha. De modo análogo, o sal aumenta a concentração do meio externo das verduras, fazendo com que elas percam água também por osmose.