Tonoscopia é uma propriedade coligativa que estuda o abaixamento da pressão máxima de vapor de um determinado solvente em virtude da dissolução de um soluto não volátil (molecular ou iônico). As outras propriedades coligativas são:
A partir da definição exposta acima, fica evidente que, para realmente entender o que é tonoscopia, é fundamental conhecer outros três conceitos:
Tópicos deste artigo
- 1 - Pressão máxima de vapor
- 2 - Mapa Mental: Tonometria ou Tonoscopia
- 3 - Dissolução
- 4 - Soluto não volátil
- 5 - Entendendo a tonoscopia
Pressão máxima de vapor
É a força exercida pelo vapor de um determinado líquido nas paredes de um recipiente fechado quando a velocidade de evaporação é igual à velocidade de condensação.
Em um recipiente com certa quantidade de etanol, que evapora com a influência da temperatura do ambiente, na medida em que o vapor encontra as paredes do recipiente, ele acaba passando para o estado líquido. Com o tempo, a velocidade de evaporação torna-se igual à velocidade de condensação. Nesse momento, a força que o vapor exerce nas paredes do recipiente é chamada de pressão máxima de vapor.
Mapa Mental: Tonometria ou Tonoscopia
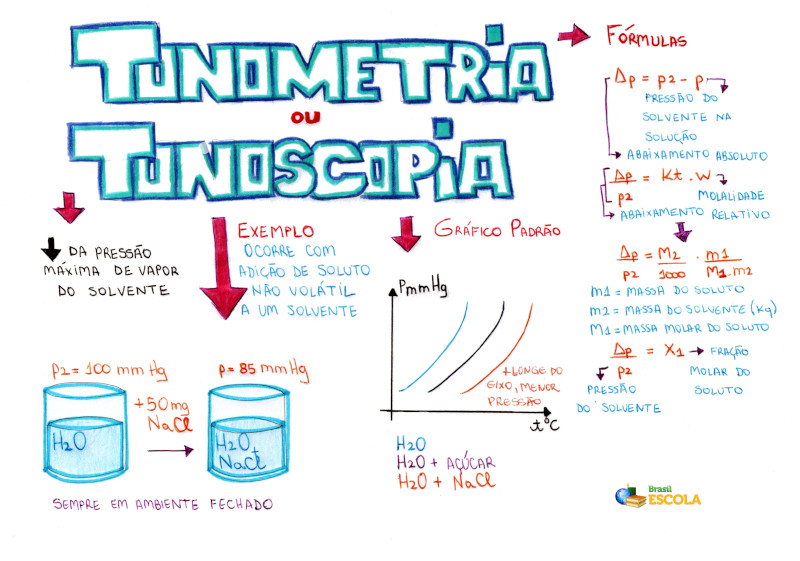
* Baixe o mapa mental sobre Tonometria ou Tonoscopia!
Dissolução
É capacidade que um solvente apresenta de dissolver um determinado soluto. Após a dissolução, soluto e solvente passam a estabelecer entre si uma interação intermolecular, ou seja, estão interligados.
Soluto não volátil
Trata-se de um material que apresenta elevado ponto de ebulição, ou seja, não pode transformar-se em gás em temperaturas ambientes, por exemplo. Dessa forma, ao ser adicionado a um solvente, não ocorrerá perda desse material para o ambiente na forma de gás.
O soluto não volátil molecular é aquele que não é capaz de sofrer ionização ou dissociação ao ser dissolvido em um solvente. Assim, se adicionarmos uma molécula desse soluto no solvente, ela ficará apenas no meio.
O soluto não volátil iônico é aquele que sofre o fenômeno de dissociação ou ionização, ou seja, nele ocorre o rompimento de ligações entre os átomos, o que provoca o fracionamento da unidade molecular. Se dissolvermos 1 mol de ácido sulfúrico (H2SO4) em água, por exemplo, teremos a presença de dois mols do cátion hidrônio e um mol do ânion sulfato no meio, como mostra a equação abaixo:
H2SO4 +2H2O → 2H+ + SO4-2
A partir do esclarecimento desses conceitos basilares, fica mais fácil e claro entender a Tonoscopia.
Entendendo a tonoscopia
Para compreender a tonoscopia, vamos estudar rapidamente o comportamento de líquidos, como a água e o etanol. Os pontos de ebulição desses dois solventes são, respectivamente, 100oC e 78oC. Assim sendo, o etanol evapora mais rápido do que a água quando estão na mesma temperatura e na mesma quantidade.
Se houver 50 mL de etanol em um recipiente e 50 mL de água em outro recipiente, por exemplo, ambos fechados e a 250oC, a pressão máxima de vapor no recipiente com etanol será maior porque a quantidade de vapor é maior em seu interior.
Graficamente falando, sempre que a curva de um líquido encontra-se mais afastada do eixo y (vertical), menor será sua pressão máxima de vapor, como no gráfico abaixo:
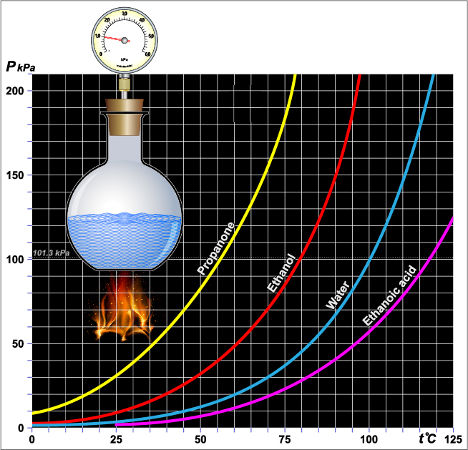
Pressão de vapor de diferentes líquidos
Legenda do gráfico: Propanone = propanona (acetona)
Ethanol = etanol
Water = Água
Ethanoic acid = Ácido etanoico
No gráfico, podemos confirmar que a pressão de vapor do etanol (curva vermelha) é sempre maior que a da água (curva azul) em qualquer temperatura.
OBS.: Resumindo, quanto maior o ponto de ebulição de um determinado solvente, menor será sua pressão máxima de vapor e vice-versa.
Como a tonoscopia estuda a diminuição da pressão máxima de vapor em razão da dissolução de um soluto não volátil no solvente, se misturarmos cloreto de sódio (NaCl) na água, a pressão máxima de vapor da água, a 100oC, que é de 760 mmHg, com certeza diminuirá. Mas por que isso acontece?
Quando o cloreto de sódio (soluto iônico) dissolve-se na água, ocorre a interação de seus íons com as moléculas da água. Essa interação torna mais difícil a evaporação do solvente. Como a evaporação foi dificultada, haverá menos vapor de água no recipiente, o que causará uma diminuição da pressão máxima de vapor.
Assim, quanto maior a quantidade de cloreto de sódio em uma mesma quantidade de água, mais difícil será a evaporação e menor ainda será a pressão máxima de vapor.
Por Me. Diogo Lopes Dias
